题目内容
15.现用如图所示的装置制取饱和氯水并测定饱和氯水的pH.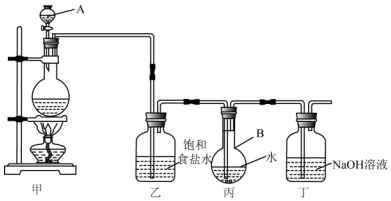
回答有关问题:
(1)装置甲中加入的药品是浓盐酸和二氧化锰,该反应中盐酸的作用是还原剂、酸性;
(2)装置乙的作用是除去氯化氢;
(3)制取结束时,装置丙的液体颜色是浅黄绿色,溶液中含有的微粒是Cl2、H2O、HClO、H+、Cl-、OH-、ClO-;
(4)装置丁的作用是吸收氯气,写出反应的化学方式:2NaOH+Cl2=NaCl+NaClO+H2O.
(5)某学生打算用pH试纸测定饱和氯水的pH,试分析他的实验方案是否可行?说明理由.不可行,氯水可漂白试纸.
分析 加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,反应的化学方程式为MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于盐酸易挥发,生成的氯气中混用氯化氢,乙作用用于除去氯化氢气体,丙用于制备氯水,溶液达到饱和时,呈浅黄绿色,由于氯气有毒,且可与氢氧化钠溶液反应,则丁用于吸收氯气,防止污染环境,以此解答该题.
解答 解:(1)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,反应的化学方程式为MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中盐酸被氧化,且生成氯化锰,可知盐酸起到还原剂和酸的作用,故答案为:还原剂、酸性;
(2)氯气不溶于饱和食盐水,装置乙用于除去氯化氢气体,故答案为:除去氯化氢;
(3)溶液达到饱和时,呈浅黄绿色,氯气和水反应生成盐酸和次氯酸,氯水中含有的微粒有Cl2、H2O、HClO、H+、Cl-、OH-、ClO-,
故答案为:浅黄绿色;Cl2、H2O、HClO、H+、Cl-、OH-、ClO-;
(4)由于氯气有毒,且可与氢氧化钠溶液反应,则丁用于吸收氯气,防止污染环境,反应的方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:吸收氯气;2NaOH+Cl2=NaCl+NaClO+H2O;
(5)由于氯水中含有次氯酸,次氯酸具有强氧化性和漂白性,可漂白试纸,不能用pH试纸测定溶液的pH,应用pH计,
故答案为:不可行,氯水可漂白试纸.
点评 本题考查氯气的制备以及性质实验的设计,为高考常见题型和高频考点,题目难度中等,试题侧重对学生基础知识的训练和检验,有利于培养学生的实验能力,提高学生灵活运用基础知识解决实际问题的能力.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案| A. | 溶液快速褪色 | B. | 溶液缓慢褪色 | C. | 生成白色沉淀 | D. | 无现象 |
| A. | K2S溶液 | B. | SO2 | C. | 双氧水 | D. | FeSO4溶液 |
| A. | 热的纯碱溶液去油污效果比冷的纯碱溶液去油污效果好 | |
| B. | 加热稀醋酸溶液其pH 稍有减小 | |
| C. | 实验室制FeCl3溶液时,把FeCl3固体溶于浓盐酸中,再加水稀释到所需的浓度 | |
| D. | 草木灰与铵态氮肥不能混合使用 |
| A. | 加入少量W,逆反应速率增大 | |
| B. | 升高温度时,正反应速率增大,逆反应速率减小 | |
| C. | 压强不变,充入与反应体系不反应的N2,Z的物质的量减少 | |
| D. | 平衡后加入X,上述反应的△H增大 |

