题目内容
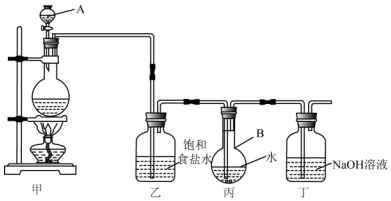
3.将等体积的SO2 和Cl2充分的混合后,通入加有品红的氯化钡溶液,可观察到的现象是( )| A. | 溶液快速褪色 | B. | 溶液缓慢褪色 | C. | 生成白色沉淀 | D. | 无现象 |
分析 根据SO2具有还原性,Cl2具有氧化性,利用二者发生的氧化还原反应来分析.
解答 解:因SO2具有还原性,Cl2具有氧化性,
则等体积的SO2和Cl2充分混合发生SO2+Cl2+2H2O═H2SO4+2HCl,
又SO2和Cl2都没有剩余,则不能使品红褪色,
生成的硫酸与氯化钡反应生成白色的硫酸钡沉淀,
故选C.
点评 本题考查氯气、二氧化硫的性质,熟悉二者等物质的量混合发生的氧化还原反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
18.下列关于SO2的叙述中不正确的是( )
| A. | 可用向上排空气法收集 | B. | 与水反应生成硫酸 | ||
| C. | 可用于漂白纸浆、草帽等 | D. | 不能与氯化钡溶液发生反应 |
19.下列有关实验操作、现象及结论都正确的是( )
| 选项 | 实验操作 | 实验结论 |
| A | 在空气中切开金属钠,表面迅速变暗 | 金属钠遇空气生成Na2O2 |
| B | 将稀盐酸分别缓慢滴入到相同物质的量浓度的Na2CO3和NaHCO3溶液中,只有一种溶液产生气体 | 产生气体的是NaHCO3溶液 |
| C | 用玻璃棒蘸取某溶液在酒精灯上灼烧,焰色反应为黄色 | 该溶液中含Na元素 |
| D | 向FeCl2溶液中悬垂滴加NaOH溶液生成白色沉淀 | 实验室中可以用这种方法制取Fe(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
11. 合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.
合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.
达到平稳时混合气体中氨的含量(体积百分比)(氮气和氢气的体积比是1:3)
如图是一透热性能很好的坚固容器,活塞C可左右移动.其总体积为44.8L,现将400℃、300大气压的氢气33.6L和400℃、300大气压的氮气11.2L充入容器中,当两者反应达到动态平稳时,若保持混合气体的温度和压强仍为400℃和300大气压,求:
(1)容器是向外界放热,还是吸热?为什么?
(2)试计算充入容器中氮气质量是多少克?
(3)活塞C要向左侧移动的距离与容器全长之比是多少?
 合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.
合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.达到平稳时混合气体中氨的含量(体积百分比)(氮气和氢气的体积比是1:3)
 | 100 | 200 | 300 | 600 | 1000 |
| 200 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
(1)容器是向外界放热,还是吸热?为什么?
(2)试计算充入容器中氮气质量是多少克?
(3)活塞C要向左侧移动的距离与容器全长之比是多少?
8.下列对有关物质分类的说法错误的是( )
| A. | “面粉增白剂”中的过氧化钙(CaO2)属于氧化物 | |
| B. | “苏打水”中的碳酸氢钠,制作“毒豆芽”所用的亚硝酸钠都属于钠盐 | |
| C. | 35Cl和37Cl互称为同位素,红磷、白磷互为同素异形体 | |
| D. | “碘片”和“加碘盐”都属于混合物,其中“碘”是单质碘 |
12.下列叙述不正确的是( )
| A. | 工业上用电解法冶炼钠、镁、铝等活泼金属 | |
| B. | 粗铜精炼时,与电源负极相连的是纯铜,该电极反应式为Cu2++2e-=Cu | |
| C. | 由C(s,石墨)=C(s,金刚石)△H=+1.9kJ/mol可知,金刚石比石墨稳定 | |
| D. | 反应SO2(g)+2H2S(g)=3S (s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 |
13.CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应的说法中正确的是( )


| A. | 该反应为吸热反应 | |
| B. | CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)所具有的总能量 | |
| C. | 反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=41 kJ•mol-1 | |
| D. | 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和H2O(g)要放出41 kJ的热量 |