题目内容
13.乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平.结合如图1路线回答:已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)反应II的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
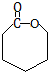
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是
 .
.(3)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3
 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

分析 乙烯含有碳碳双键,能发生加聚反应,生成聚乙烯,则D是聚乙烯.乙烯和水发生加成反应生成乙醇,则A是乙醇.乙醇发生氧化反应生成B,所以B是乙醛.乙醛继续被氧化生成乙酸,所以C是乙酸.乙酸和乙醇发生酯化反应生成乙酸乙酯,则E是乙酸.(3)中制备乙酸乙酯由于生成的乙酸乙酯中含有乙酸和乙醇,二者都是与水互溶的,吸收装置中如果直接插入到碳酸钠溶液中,容易引起倒吸;(4)中实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,应保证乙酸、乙醇、氢离子浓度相等;分析使用浓硫酸和稀硫酸的实验,比较哪种条件下生成的乙酸乙酯多,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
解答 解:乙烯含有碳碳双键,能发生加聚反应,生成聚乙烯,则D是聚乙烯.乙烯和水发生加成反应生成乙醇,则A是乙醇.乙醇发生氧化反应生成B,所以B是乙醛.乙醛继续被氧化生成乙酸,所以C是乙酸.乙酸和乙醇发生酯化反应生成乙酸乙酯,则E是乙酸.
(1)反应II是乙醇的催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(2)D为聚乙烯,属于高分子化合物,可以用来制造多种包装材料,其结构简式是 ,
,
故答案为: ;
;
(3)①反应IV是制备乙酸乙酯的,反应的化学方程式是:CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O,属于酯化反应或取代反应,
CH3COOCH2CH3+H2O,属于酯化反应或取代反应,
故答案为:CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O,酯化反应或取代反应;
CH3COOCH2CH3+H2O,酯化反应或取代反应;
②由于生成的乙酸乙酯中含有乙酸和乙醇,二者都是与水互溶的,吸收装置中如果直接插入到碳酸钠溶液中,容易引起倒吸,所以该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下,
故答案为:导气管的出口伸入到饱和碳酸钠溶液液面以下;
(4)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,应保证乙酸、乙醇、氢离子浓度相等,实验C中 2mL乙醇、1mL乙酸、3mL 2mol•L-1 H2SO4,实验D中 2mL乙醇、1mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,故盐酸体积为3mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为$\frac{3mL×2mol/L×2}{3mL}$=4mol/L,
故答案为:4;
②根据表中数据可知,实验A和C中分别加入了浓硫酸和稀硫酸,所以通过分析实验A、C的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率,
故答案为:AC.
点评 本题考查有机物的推断、有机反应类型、方程式的书写以及实验方案分析与评价等,题目基础性较强,涉及烯、醇、酯、羧酸等性质与转化,是对有机知识的综合运用,该题的难点是乙酸乙酯制备的实验分析和判断以及实验方案与设计评价.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
(1)装置A、B中的试剂X和试剂Y分别是b(填字母代号).
a.NaOH溶液 浓硫酸 b.NaCl溶液 浓硫酸 c.浓硫酸 石灰水
(2)若C中有色布条不褪色,D中有色布条褪色.则具有漂白性的物质是次氯酸(填物质名称),该实验证明氯气能与水反应,反应的离子方程式为Cl+H2O=H++Cl-+HClO.
(3)从绿色化学的角度分析,上述实验装置图中存在一处缺陷,改正的方法是加一个尾气处理装置,该尾气处理装置内发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)实验完毕后,将D中的水溶液(呈黄绿色)取出,分别加入两支试管中,进行如下实验
| 实验编号 | 滴加的试剂 | 实验现象 | 证明存在的微粒 (填微粒符号) |
| A | AgNO3 溶液 | a.产生白色沉淀 | b.Cl- |
| B | 紫色石蕊溶液 | c.先变红色后褪色 | d.H+,HClO |
| A. | 硅是非金属 | |
| B. | 它是非金属氧化物 | |
| C. | 二氧化硅能跟氢氧化钠反应生成盐和水 | |
| D. | 它的对应水化物是弱酸,能溶于水 |

实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是Ba2SO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2=2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:甲--有大量白色沉淀;乙--有少量白色沉淀检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释实验现象异同的原因:甲:SO42-+Ba2+→BaSO4↓,乙:2Ba2++2SO2+O2+2H2O→2BaSO4↓+4H+
白雾的量远多于装置中O2的量.
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.
| A. | 100 mL 0.1 mol•L-1 Na2SO4溶液中,粒子总数是0.03NA | |
| B. | 常温常压下,32 g O2-中所含电子的数目为17NA | |
| C. | 1 mol Al3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
 甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:
甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:Ⅰ.已知:甲是常见单质,丙为氢气.
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe.
(2)若甲为碳,则产物乙、丙可合成甲醇.
①已知:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1
CH4(g)+H2O(g)?CH3OH(g)+H2(g)△H=+77.0kJ•mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1.
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表.则T1< T2(填“>”“<”、“=”).
| 温度/℃ | T1 | T2 |
| K | 2.041 | 0.012 |
Ⅱ.已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性.
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体.则构成甲的阴、阳离子半径大小关系为N3->Mg2+(用具体的微粒表示).
(4)若乙是O2,则甲的一种重要用途是供氧剂或漂白剂;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是c(Cl-)>c(ClO-)>C(OH-).
| A. | HCl MgCl2NH4Cl | B. | H2O Na2O? CO2 | ||
| C. | CaCl2? NaOH H2O | D. | NH3•H2O CO2 |
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤是由有机化合物和无机物组成的复杂的混合物 | |
| D. | 煤中含有苯和甲苯,可以用分馏的方法把它们从煤中分离出来 |

 $\stackrel{过氧化物}{→}$
$\stackrel{过氧化物}{→}$  (R,R′代表烃基)
(R,R′代表烃基) .
. .
. .
. .
. 或
或 .
. .
.