题目内容
2. 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | H2O2分解的热化学方程式:H2O2═H2O+$\frac{1}{2}$O2△H<0 |
分析 A、催化剂只通过改变活化能来改变反应速率,不改变反应的热效应;
B、催化剂只改变反应速率不改变化学平衡;
C、图象分析反应是放热反应,反应物的总能量高于生成物的总能量;
D、图象分析反应是放热反应,热化学方程式要注明状态.
解答 解:A、催化剂只通过改变活化能来改变反应速率,不改变反应的热效应;故A错误;
B、催化剂只改变反应速率不改变化学平衡,反应体系中加入催化剂不改变H2O2的平衡转化率,故B错误;
C、图象分析反应是放热反应,所以反应物的总能量高于生成物的总能量,故C正确;
D、图象分析判断反应是放热反应,热化学方程式要注明状态,所以H2O2分解的热化学方程式:H2O2(l)=H2O(l)+$\frac{1}{2}$O2(g)△H>0,故D错误;
故选C.
点评 本题考查了化学平衡、化学反应能量的图象分析判断,注意催化剂改变速率不改变平衡的理解,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列反应的离子方程式中正确的是( )
| A. | Na2O2与水反应:Na2O2+2H20═2Na++2OH-+H2↑ | |
| B. | FeSO4溶液与H2O2溶液混合:Fe2++H2O2+2H+═Fe3++2H2O | |
| C. | 向Na2SiO3溶液中通人过量的SO2:SiO32-+SO2+H2O═Na2SiO3↓+SO32- | |
| D. | NH4HCO3稀溶液与过量的Ca(OH)2溶液混合:NH4++HC03-+Ca2++2OH-═CaCO3↓+NH3•H2O+H20 |
13.镁铁混合物13.8g溶解在足量某浓度的稀硝酸中,完全反应,其还原产物只有一氧化氮(0.3mol),则向反应后的溶液中加入足量的NaOH溶液,可生成的沉淀质量为( )
| A. | 26 | B. | 29.1g | C. | 29.5g | D. | 24g |
10.以铝合金、Pt-Fe合金网为电极材料制成海水电池.下列关于这种电池的说法:①铝合金是阳极、②铝合金是负极、③海水是电解液、④铝合金电极发生还原反应,其中正确的是( )
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
7.下列装置能达到实验目的是( )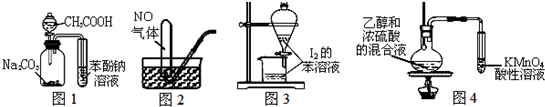

| A. | 图1证明酸性:CH3COOH>H2CO3>苯酚 | |
| B. | 图2用排水法收集NO | |
| C. | 图3萃取碘水中I2,分出水层后的操作 | |
| D. | 图4验证乙烯的生成 |
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═AlO2-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na:2 Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ |
8.已知H2SO4(aq)与Ba(OH)2(aq)反应的△H=-140.9kJ/mol;HCl(aq)与NaOH(aq)反应的△H=-57.3kJ/mol,则生成BaSO4(s)的反应热等于( )
| A. | -83.6kJ/mol | B. | -26.3kJ/mol | C. | 26.3kJ/mol | D. | 83.6kJ/mol |
 据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.
据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物. 空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.
空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.