题目内容
某元素原子的质量数为A,它的阳离子Xn+核外有x个电子,w克这种元素的原子核内中子数为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:先利用n=
计算原子的物质的量,再由阳离子中质子数=核外电子数+电荷数求出质子数,最后利用质子数与中子数之和等于质量数来计算中子数.
| m |
| M |
解答:
解:w克这种元素的原子的物质的量为
mol,阳离子Xn+核外有x个电子,则质子数为x+n,中子数为A-(x+n)=A-x-n,
则w克这种元素的原子核内中子数为
mol×(A-x-n)=
;
故选:C.
| w |
| A |
则w克这种元素的原子核内中子数为
| w |
| A |
| w(A-x-n) |
| A |
故选:C.
点评:本题考查学生利用原子构成的简单计算,明确原子的物质的量的计算是解答本题的关键,注意质量数在数值上等于摩尔质量.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列离子方程式中正确的是( )
| A、NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO4_2-=BaSO4↓+2H2O |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、次氯酸钠溶液中通入SO2气体:2ClO-+SO2+H2O═2HClO+SO42- |
| D、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
下列描述的一定是金属元素的是( )
| A、易失去电子的物质 |
| B、能与酸反应的物质 |
| C、原子最外电子层只有一个电子的元素 |
| D、原子核内有11个质子的元素 |
下列关于能源和作为能源物质的叙述中错误的是( )
| A、燃料燃烧时将化学能全部转化为热能 |
| B、绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 |
| C、物质的化学能可以在不同条件下转为热能、电能为人类所利用 |
| D、化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 |
在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+B(?)?xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4.下列判断不正确的是( )


| A、x=2 |
| B、若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态 |
| C、A为气体,B为非气体,则平衡时M、N中C的物质的量相等 |
| D、若A、B均为气体,平衡时M中A的转化率小于N中A的转化率 |
下列叙述正确的是( )
| A、金属氧化物均为碱性氧化物 |
| B、酸性氧化物均为非金属氧化物 |
| C、熔融态能导电的物质是电解质 |
| D、一定条件下电解质能电离为离子 |
下列溶液中的Cl-浓度与50mL 1mol/L的AlCl3 溶液中Cl-的浓度相等的是( )
| A、0.3mol NaCl 溶于100mL水中 |
| B、75mL 1.5mol/L的CaCl2 |
| C、500mL 溶液中含3mol的KCl |
| D、150mL 1mol/L的 NaCl |
X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物分别为酸性氧化物、碱性氧化物、两性氧化物,则这三种元素原子序数的大小顺序是( )
| A、X>Y>Z |
| B、X>Z>Y |
| C、Y>X>Z |
| D、Y>Z>X |
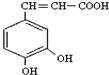 )也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.
)也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.