题目内容
8.常温下向10 mL 0.1 mol/L氨水中缓缓加蒸馏水稀释到1 L后,下列变化中正确的是( )①电离程度增大 ②c(H+)增大 ③导电性增强
④$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$不变 ⑤NH4+数目减小 ⑥c(NH3•H2O)增大.
| A. | ①②④ | B. | ②③⑥ | C. | ①③⑤ | D. | ②④⑥ |
分析 加水稀释促进一水合氨电离,溶液中c(NH3.H2O)、c(NH4+)、c(OH-)都减小,但 c(H+)增大,据此分析解答.
解答 解:加水稀释促进一水合氨电离,溶液中c(NH3.H2O)、c(NH4+)、c(OH-)都减小,但 c(H+)增大,
①加水稀释促进电离,所以一水合氨电离程度增大,故正确;
②溶液温度不变,则水的离子积常数不变,氢氧根离子浓度减小,则c(H+)增大,故正确;
③溶液中离子浓度减小,则导电性减弱,故错误;
④温度不变,一水合氨电离平衡常数$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$不变,故正确;
⑤加水稀释促进一水合氨电离,NH4+数目增大,故错误;
⑥加水稀释促进一水合氨电离,c(NH3•H2O)减小,故错误;
故选A.
点评 本题考查了弱电解质的电离,明确弱电解质电离程度与溶液浓度的关系是解本题关键,知道稀释过程中各种微粒浓度变化,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.常温下,下列叙述错误的是( )
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
17.下列关于有机物的说法正确的是( )
| A. | 乙烯和苯分子中均含有碳碳双键,二者都能发生加成反应 | |
| B. | 汽油、煤油、植物油均为含碳、氢、氧三种元素的化合物 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 羊毛、蚕丝和棉花等天然高分子材料的主要成分都是蛋白质 |
18.下列化学式所代表的物质一定是纯净物的是( )
| A. | C2H6O | B. | CH2Cl2 | C. | C2H4Cl2 | D. | C2H4O2 |
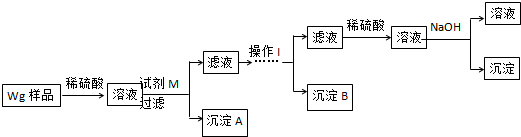
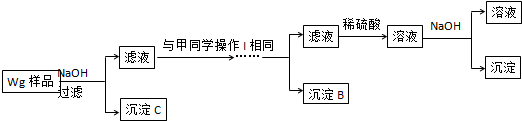


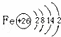 .
.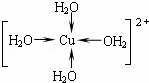 .
. 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.