题目内容
7.已知:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H=-QkJ•mol-1 现将1molSO2气体和0.5molO2在一个密闭容器中,进行和上述相同条件下的反应,充分反应后测得放出热量为Q1kJ,则Q2和Q的关系是( )| A. | Q1=$\frac{1}{2}$Q | B. | Q1<$\frac{1}{2}$Q | C. | Q1>$\frac{1}{2}$Q | D. | Q1=Q |
分析 根据可逆反应的特点可知,可逆反应是不能进行到底的反应,即反应后的体系中含有所有反应物和生成物,据此判断Q2和Q的关系.
解答 解:若将 1mol SO2和0.5mol O2在相同条件下放入密闭容器发生反应,因2SO2+O2?2SO3是可逆反应,则 1mol SO2和0.5mol O2不会完全反应生成1molSO3,即生成SO3的量小于1mol,而生成2mol SO3 放出的热量为Q,生成1mol SO3 放出的热量为0.5Q,
所以生成小于1mol的SO3时放出的热量必小于0.5Q,即 Q1<$\frac{1}{2}$Q,
故选B.
点评 本题考查了可反应热的计算、可逆反应特点,明确可逆反应特点为解答关键,注意掌握反应热的计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.下列离子方程式中,错误的是( )
| A. | 氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3•H2O | |
| C. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
15.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图.
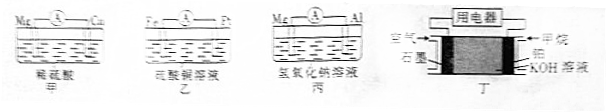
(1)根据原电池原理填写下表.
(2)电极类型除与电极材料的性质有关外,还与电解质溶液有关.
(3)根据上述电池分析,负极材料是否一定参加电极反应?不一定(填“是”“不是”或“不一定”).
(4)上述电池的放电过程中,丙中电解质溶液的碱性减弱(填“增强”“减弱”或“不变”,下同),丁中电解质溶液的碱性减弱.

(1)根据原电池原理填写下表.
| 装置序号 | 负极 | 阳离子移向 (填电极材料名称) |
| 甲 | ||
| 乙 | . |
(3)根据上述电池分析,负极材料是否一定参加电极反应?不一定(填“是”“不是”或“不一定”).
(4)上述电池的放电过程中,丙中电解质溶液的碱性减弱(填“增强”“减弱”或“不变”,下同),丁中电解质溶液的碱性减弱.
12.准确称取一定量纯净的H2C2O4•2H2O于锥形瓶中,加入适量的蒸馏水和稀硫酸,用未知浓度的高锰酸钾溶液进行滴定,从而标定高锰酸钾溶液的浓度.下列说法正确的是( )
| A. | KMnO4溶液可盛放在碱式滴定管中 | |
| B. | 可用酚酞或甲基橙作滴定的指示剂 | |
| C. | 若滴定管未用待测KMnO4溶液润洗,则会使测得的KMnO4溶液浓度偏小 | |
| D. | 滴定过程中褪色速率先慢后快,是由于锥形瓶中KMnO4溶液浓度不断增大 |
 ;
; .
.
 (g)+O2(g)==2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
(g)+O2(g)==2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1