题目内容
4.只用胶头滴管和试管,不能区别的溶液是( )| A. | CaCl2和Na2CO3 | B. | 稀盐酸和Na[Al(OH)4] | C. | 稀盐酸和Na2CO3 | D. | NaOH和AlCl3 |
分析 与量有关的反应,改变滴定顺序,现象不同可鉴别,以此来解答.
解答 解:A.二者反应生成沉淀,与量无关,不能鉴别,故A选;
B.盐酸少量生成沉淀,盐酸过量沉淀溶解,可鉴别,故B不选;
C.盐酸少量不生成气体,盐酸过量生成气体,可鉴别,故C不选;
D.NaOH少量生成白色沉淀,NaOH过量沉淀溶解,可鉴别,故D不选;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握与量有关的反应为解答的关键,侧重与量有关的反应及分析与应用能力的考查,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
19.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是614C;
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
9.(1)实验室要使AlCl3溶液中的Al3-全部沉淀出来,最适宜用方法是(用离子方程式表示)Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(2)现有如下两个反应:
A:2NaOH+H2SO4=Na2SO4+2H2O B:CH4+2O2=CO2+2H2O
根据反应的本质,两个反应都为放热反应(填“放热”或“吸热”);
(3)下列各项分别与哪个影响化学反应速率因素的关系最为密切?
①夏天的食品易变霉,在冬天不易发生该现象:温度;
②双氧水中加入MnO2放出气泡更快:催化剂;
③同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢:反应物本身性质;
④黄铁矿煅烧时要粉碎成细小的矿粒:固体表面积;
(4)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计如下实验(所取溶液体积均为10mL)
其他条件不变时:探究浓度对化学反应速率的影响,应选择①②和③④(填试验编号),探究温度对化学反应速率的影响,应选择①④(填试验编号);
(5)某元素的同位素R形成的最高价氧化物的化学式是RO2,其气态氢化合物中含氢25%,且已知R原子核内的质子数等于中子数.则:R的质数量为12,质子数为6.
(2)现有如下两个反应:
A:2NaOH+H2SO4=Na2SO4+2H2O B:CH4+2O2=CO2+2H2O
根据反应的本质,两个反应都为放热反应(填“放热”或“吸热”);
(3)下列各项分别与哪个影响化学反应速率因素的关系最为密切?
①夏天的食品易变霉,在冬天不易发生该现象:温度;
②双氧水中加入MnO2放出气泡更快:催化剂;
③同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢:反应物本身性质;
④黄铁矿煅烧时要粉碎成细小的矿粒:固体表面积;
(4)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计如下实验(所取溶液体积均为10mL)
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(5)某元素的同位素R形成的最高价氧化物的化学式是RO2,其气态氢化合物中含氢25%,且已知R原子核内的质子数等于中子数.则:R的质数量为12,质子数为6.
13.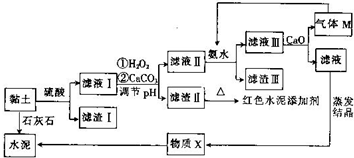 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
已知:黏土的主要成分为2CaO•3Al2O3•FeO•Fe2O3•10SiO2•nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
(1)为提高酸浸速率,除适当增大硫酸浓度外,还可采取的措施有搅拌、适当升温或将研磨黏土(任写一条).
(2)向滤液Ⅰ中加入H2O2的作用是将滤液中的Fe2+氧化为Fe3+;用CaCO3调节溶液pH约为3.3,其目的是使Fe3+完全转化为Fe(OH)3沉淀而除去.
(3)红色水泥添加剂的主要成分是Fe2O3.
(4)物质X的化学式为CaSO4•2H2O.
(5)气体M的电子式为 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.已知:黏土的主要成分为2CaO•3Al2O3•FeO•Fe2O3•10SiO2•nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
(2)向滤液Ⅰ中加入H2O2的作用是将滤液中的Fe2+氧化为Fe3+;用CaCO3调节溶液pH约为3.3,其目的是使Fe3+完全转化为Fe(OH)3沉淀而除去.
(3)红色水泥添加剂的主要成分是Fe2O3.
(4)物质X的化学式为CaSO4•2H2O.
(5)气体M的电子式为
 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
14.北京和张家口市联合申办2022年冬奥会,目前北京市政府正在全力改善空气质量.以下不在空气质量报告范围内的是( )
| A. | 二氧化硫(SO2) | B. | 总悬浮颗粒物(TSP) | C. | 二氧化氮(NO2) | D. | 二氧化碳(CO2) |

 ;
; .
.