题目内容
11.足量MnO2与VmL 10mol/L的盐酸共热制氯气,在标准状况下制2.24LCl2则V的取值为( )| A. | V>40 | B. | 20<V<40 | C. | V=40 | D. | V=20 |
分析 发生MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,浓盐酸变为稀盐酸后,稀盐酸与二氧化锰不反应,则实际消耗盐酸大于理论计算值,以此来解答.
解答 解:n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,n(HCl)=4n(Cl2)=0.4mol,
则消耗盐酸的体积V′=$\frac{0.4mol}{10mol/L}$=0.04L=40mL,
浓盐酸变为稀盐酸后,稀盐酸与二氧化锰不反应,则实际消耗盐酸大于理论计算值,即V>40,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,注意稀盐酸与二氧化锰不反应,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
1.高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
①缓慢向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图2,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).
(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
(4)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4溶液.用平衡移动原理解释加入MnS的作用MnS(S)?Mn2+(aq)+S2-(aq)、S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.

①缓慢向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图2,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).
(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.
19.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法不正确的是( )
| A. | 开始滴加氨水时形成的难溶物为Cu(OH)2 | |
| B. | 沉淀溶解后,生成深蓝色的配合离子[Cu(NH3)4]2+配位数为4 | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| D. | [Cu(NH3)4]2+中,Cu2+提供空轨道,NH3给出孤电子对 |
6.下列叙述中,正确的是( )
| A. | 相对分子质量相同、结构不同的化合物一定互为同分异构体 | |
| B. | 含不同碳原子数的烷烃一定互为同系物 | |
| C. | 结构对称的烷烃,其一氯取代产物必定只有一种 | |
| D. | 分子通式相同且组成上相差一个或几个CH2原子团的物质互为同系物 |
16.下列图示操作正确的是( )
| A. | 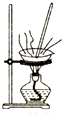 灼烧 | B. | 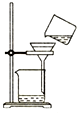 过滤 | ||
| C. | 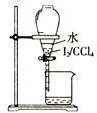 分液 | D. | 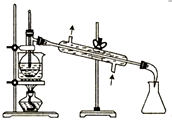 蒸馏 |
3.下列物质的用途跟其化学性质相关的是( )
| A. | 干冰用于人工降雨 | B. | 铁粉用于食品保存 | ||
| C. | 稀有气体用来制作电光源 | D. | 铜用作电线 |


 .
. (其中任一种).
(其中任一种).
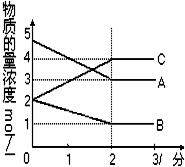 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示 2C.
2C.