题目内容
15.下列做法不存在安全隐患或不会导致实验失败的是( )| A. | 氢气还原氧化铜当反应完成后,先停止通氢气再停止加热 | |
| B. | 将饱和FeCl3溶液加热煮沸来制备Fe(OH3胶体) | |
| C. | 工业制备HCl气体时将氢气和氯气的混合气体在光照条件下反应 | |
| D. | 浓硫酸稀释时如图操作 |
分析 A.氢气还原氧化铜时,为防止生成的铜被氧化,则后停止氢气;
B.应在沸水中滴加饱和氯化铁溶液;
C.光照条件下易发生爆炸;
D.稀释浓硫酸应避免酸液飞溅.
解答 解:A.氢气还原氧化铜时,为防止生成的铜被氧化,所以先停止加热再停止通氢气,故A错误;
B.将25mL蒸馏水加至沸腾,向沸水中逐滴加入氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热就能制得氢氧化铁胶体,故B错误;
C.光照条件下易发生爆炸,应点燃,故C错误;
D.稀释浓硫酸应避免酸液飞溅,浓硫酸的密度比水的大,所以应该将浓硫酸缓缓加入水中,然后用玻璃棒不断搅拌,使产生的热量及时散失.故D正确.
故选D.
点评 本题综合考查化学实验的评价,为高频考点,侧重考查学生的分析、实验能力,注意把握实验的操作方法以及实验的可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.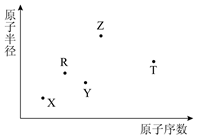 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )| A. | 最高价氧化物对应水化物的酸性R>T | |
| B. | 氢化物的沸点一定是Y>R | |
| C. | 原子半径和离子半径均满足Y<Z | |
| D. | 由X、Y、Z、T四种元素组成的化合物中既含有离子键又含有共价键 |
6.下列物质的检验,其结论一定正确的是( )
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- | |
| B. | 取少量久置的Na2SO3样品于试管中加水溶解,再加足量盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化 | |
| C. | 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- | |
| D. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2 |
3.医学上由于肾功能衰竭会引起血液中毒,需进行净化排毒,常用的血液净化方法与下列过程相似的是( )
| A. | 聚沉 | B. | 电泳 | C. | 渗析 | D. | 过滤 |
20.水是生命之源,下列有关各种“水”的说法中正确的是( )
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 新制备的氯水中存在七种粒子 | |
| D. | 氨水能导电,说明氨气是电解质 |
7. Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为4H++4I-+O2=2I2+2H2O.
(2)该实验的目的是探究温度对反应速率的影响.
(3)实验试剂除了1mol/L KI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色.
(4)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
Ⅱ、分别取40mL 0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE.
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
某学生实验记录数据如表:
依据该学生的实验数据计算,该实验测得的中和热为△H=-51.8kJ/mol.
假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比所求中和热相等(填“相等”或“不相等”).
 Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为4H++4I-+O2=2I2+2H2O.
(2)该实验的目的是探究温度对反应速率的影响.
(3)实验试剂除了1mol/L KI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色.
(4)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
Ⅱ、分别取40mL 0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE.
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
某学生实验记录数据如表:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比所求中和热相等(填“相等”或“不相等”).
4.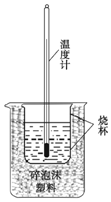 实验室利用如图装置进行中和热的测定. 回答下列问题:
实验室利用如图装置进行中和热的测定. 回答下列问题:
(1)该图中有两处未画出,它们是环形玻璃搅拌棒和烧杯上方盖硬纸板.
(2)把温度为13℃,浓度为1.0mol•L-1的盐酸和1.1mol•L-1的碱溶液 各 50mL混合,轻轻搅动,测得酸碱混合液的温度变化数据如表:
则a>b(填“>”“<”“=”);实验中碱液过量的目的是使盐酸充分反应,提高实验的准确度.已知:稀溶液的密度近似为1g/mL,其比热容约为4.18J/(g•℃),则a=56.8.
 实验室利用如图装置进行中和热的测定. 回答下列问题:
实验室利用如图装置进行中和热的测定. 回答下列问题:(1)该图中有两处未画出,它们是环形玻璃搅拌棒和烧杯上方盖硬纸板.
(2)把温度为13℃,浓度为1.0mol•L-1的盐酸和1.1mol•L-1的碱溶液 各 50mL混合,轻轻搅动,测得酸碱混合液的温度变化数据如表:
| 反应物 | 起始温度(℃) | 终了温度(℃) | 中和热(kJ•mol-1) |
| ①HCl+NaOH | 13 | 19.8 | -a |
| ②HCl+NH3•H2O | 13 | 19.3 | -b |
5.下列各组物质中,所含化学键类型相同,融化时克服的作用力也相同的是( )
| A. | 明矾和金刚石 | B. | 硫磺和人黄铜 | C. | 甲烷和干冰 | D. | 氯化铵和可燃冰 |