题目内容
9.比较、分析、归纳是学习化学的有效方法.现有反应:
①Zn+CuCl2═ZnCl2+Cu
②Cu+2AgNO3═Cu(NO3)2+2Ag
③Cl2+2NaBr═2NaCl+Br2④Br2+2NaI═2NaBr+I2
(1)通过比较、分析.可以发现上述四个反应有相似之处:均属于四种基本反应类型中的置换反应.
(2)分析反应①和②,可以得到:Zn、Cu、Ag这二种金属的活动性由强到弱的顺序是Zn>Cu>Ag用相似的思维方法类推到反应③和④中,我们还可以得到C12、Br2、I2三种非金属的活泼性强弱,请写出氯气与碘化钾反应的方程式Cl2+2KI═2KCl+I2 .
分析 金属若想和盐发生反应生成新的金属,必须是在金属活动性顺序中前面的金属可以把排在它后面的金属从盐溶液中置换出来,即金属活动性强的金属可以把活动性弱的金属从盐溶液中置换出来,非金属单质也具有类似的性质,以此解答该题.
解答 解:(1)通过比较、分析,可以发现上述四个反应,都是由一种单质和一种化合物反应,生成了另一种单质和另一种化合物,均属于置换反应反应,
故答案为:置换;
(2)由于锌能置换出溶液中的铜,说明了锌的活动性大于铜,铜能置换出溶液中的银,说明了铜的活动性大于银,可以得到Zn Cu Ag三种金属的活动性由强到弱的顺序是Zn>Cu>Ag;Cl2能置换出溶液中的B溴,说明了Cl2的活动性大于Br2,Br2能置换出溶液中的碘,说明了Br2的活动性大于I2,我们可知Cl2、Br2、I2的非金属活动性顺序由强到弱的是Cl2>Br2>I2;氯气与碘化钾反应生成氯化钾和碘,故方程式为:Cl2+2KI═2KCl+I2
故答案为:Zn>Cu>Ag;Cl2+2KI═2KCl+I2 .
点评 该题主要考查了金属活动性顺序的应用,为高频考点,侧重于学生的分析能力和实验能力的考查,注意通过化学反应来判断金属的活动性强弱,难度不大.

练习册系列答案
相关题目
19.下列关于有机物的叙述正确的是( )
| A. | 有机物都是含有碳元素的化合物 | |
| B. | 有机物中碳元素都呈+4价 | |
| C. | 有机物都难溶于水,易溶于有机溶剂 | |
| D. | 有机物是有生命的物质 |
20.下列叙述正确的是( )
| A. | Fe与稀硝酸、稀硫酸反应均产生气泡,说明Fe与两种酸均发生置换反应 | |
| B. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| C. | Fe(OH)3胶体无色、透明,能发生丁达尔效应 | |
| D. | SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以SiO2是两性氧化物 |
4.在反应3BrF3+5H2O=HbrO3+Br2+9HF+O2中,如果有5个水分子发生反应,反应物分子中化合价升高的分子总数和化合价降低的分子总数之比为( )
| A. | 3:1 | B. | 3:2 | C. | 3:5 | D. | 5:3 |
1.将一小块金属钠投入到足量下列物质中,既能生成气体,又能生成白色沉淀的是( )
| A. | MgSO4溶液 | B. | BaCl2溶液 | C. | Fe2(SO4)3溶液 | D. | CuCl2溶液 |
12.根据碘与氢气反应的热化学方程式,下列判断正确的是
(i) H2(g)+I2(g)?2HI(g);△H=-9.48kJ/mol (ii) H2(g)+I2(s)?2HI(g);△H=+26.48kJ( )
(i) H2(g)+I2(g)?2HI(g);△H=-9.48kJ/mol (ii) H2(g)+I2(s)?2HI(g);△H=+26.48kJ( )
| A. | 1 mol I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol I2(s)升华,吸热17.00 kJ | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
 ④
④ 和
和 ⑤CH3CH2CH2CH3和
⑤CH3CH2CH2CH3和
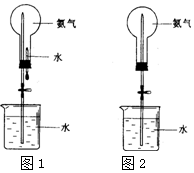 喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).
喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).