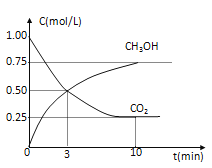
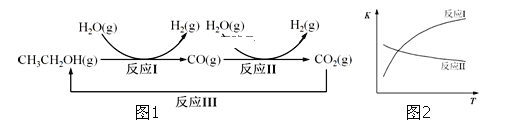
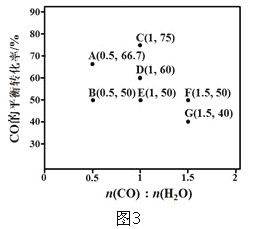
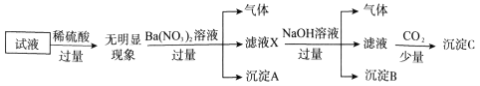
题目内容
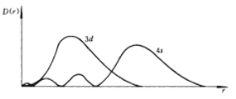
【题目】(1)如图为4s和3d电子云的径向分布图,3d轨道离原子核更近,但是根据鲍林的轨道近似能级图填充电子时,先填4s电子,而后填3d电子,试简单写出理由______。
(2)写出臭氧的Lewis结构式______![]() 只需要写出一种共振式即可
只需要写出一种共振式即可![]() 。
。
(3)根据堆积原理,可以将等径球的密堆积分为![]() 、
、![]() 、
、![]() 、
、![]() 堆积,其中
堆积,其中![]() 堆积形成抽出立方面心晶胞,又叫面心立方最密堆积,其构成的晶胞中含有4个球,写出它们的分数坐标为______。
堆积形成抽出立方面心晶胞,又叫面心立方最密堆积,其构成的晶胞中含有4个球,写出它们的分数坐标为______。
(4)关于![]() 是一个特殊的物质,高温下顺磁性,低温下抗磁性,主要是因为
是一个特殊的物质,高温下顺磁性,低温下抗磁性,主要是因为![]() 与
与![]() 可以相互转化,低温时主要以双聚分子
可以相互转化,低温时主要以双聚分子![]() 形式存在,高温时主要以单分子
形式存在,高温时主要以单分子![]() 形式存在,同时在高温时
形式存在,同时在高温时![]() 分子中存在离域
分子中存在离域![]() 键的存在,使得氧原子没有成单电子,写出
键的存在,使得氧原子没有成单电子,写出![]() 中存在离域
中存在离域![]() 键为______。
键为______。
(5)在相同的杂化类型和相同的孤对电子对数目时,分子的键角也会不相同,试比较![]() 和
和![]() 中键角的大小,
中键角的大小,![]() ______
______![]() 填“大于”或“小于”或“等于”
填“大于”或“小于”或“等于”![]() 。
。
(6)已知饱和硫化氢的浓度为![]() ,硫化氢的离解常数为
,硫化氢的离解常数为![]() ,
,![]() ,计算饱和硫化氢溶液中氢离子的浓度为______。
,计算饱和硫化氢溶液中氢离子的浓度为______。
【答案】4s轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽 
![]() 、
、![]() 、
、![]() 、
、![]()
![]() 大于
大于 ![]()
【解析】
(1)![]() 轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽,据此进行分析;
轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽,据此进行分析;
(2)整个分子是V形,中心O是![]() 杂化,分子中含一个3,4大
杂化,分子中含一个3,4大![]() 键;
键;
(3)据面心立方最密堆积,进行分析;
(4)中心原子N采取![]() 杂化,其中一个杂化轨道上填有氮的一个单电子而不是孤对电子,从而此分子中的离域
杂化,其中一个杂化轨道上填有氮的一个单电子而不是孤对电子,从而此分子中的离域![]() 键是
键是![]() ,据此进行分析;
,据此进行分析;
(5)成键电子对间的距离越远,成键电子对间的排斥力越小;
(6)![]() ,据此进行计算。
,据此进行计算。
(1)![]() 轨道离原子核更近,但是根据鲍林的轨道近似能级图填充电子时,先填4s电子,而后填3d电子,原因是4s轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽;
轨道离原子核更近,但是根据鲍林的轨道近似能级图填充电子时,先填4s电子,而后填3d电子,原因是4s轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽;
(2)整个分子是V形,中心O是![]() 杂化,分子中含一个3,4大
杂化,分子中含一个3,4大![]() 键,故臭氧的Lewis结构式为
键,故臭氧的Lewis结构式为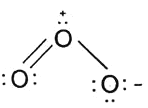 ;
;
(3)面心立方最密堆积,则晶胞中含有4个球,它们的分数坐标为![]() 、
、![]() 、
、![]() 和
和![]() ;
;
(4)中心N原子采取![]() 杂化,其中一个杂化轨道上填有氮的一个单电子而不是孤对电子,从而此分子中的离域
杂化,其中一个杂化轨道上填有氮的一个单电子而不是孤对电子,从而此分子中的离域![]() 键是
键是![]() ;
;
(5)氟的电负性大于氢,因此用于![]() 成键的电子对更偏向氟
成键的电子对更偏向氟![]() 或离氮原子核较远
或离氮原子核较远![]() ,氮周围电子密度减小
,氮周围电子密度减小![]() 或
或![]() 成键电子对间的“距离”较远
成键电子对间的“距离”较远![]() ,斥力较小,因而键角较小,故,
,斥力较小,因而键角较小,故,![]() 大于
大于![]() ;
;
(6)![]() 。
。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案