题目内容
5.下列哪一种方法能证明一种无色液体是纯净的水( )| A. | 测得这种液体的pH值等于7 | |
| B. | 在1.01×105Pa的压强下测得其沸点为373K | |
| C. | 电解这种液体,在阴极得到的气体体积为阳极气体体积的两倍 | |
| D. | 测得该液体不导电 |
分析 A.pH=7的液体不一定是纯净水,如NaCl溶液的pH=7;
B.每一种液体都有其固定的沸点,在1.01×105 Pa压强下测得该液体的沸点为100℃,说明该液体是纯净水;
C.电解活泼金属的含氧酸盐时,得到H2、O2,体积比为2:1;
D.汽油、酒精灯均不能导电.
解答 解:A.pH=7的液体不一定是纯净水,如NaCl溶液的pH=7,故A错误;
B.每一种液体都有其固定的沸点,在1.01×105 Pa压强下测得该液体的沸点为100℃,说明该液体是纯净水,故B正确;
C.电解活泼金属的含氧酸盐时,得到H2、O2,体积比为2:1,不能确定是否含有纯水,比如电解硫酸钠、硝酸钠等,故C错误,故C错误;
D.常见有机化合物液体状态下均不能导电,比如酒精、汽油,不能说明是水,故D错误;故选B.
点评 本题考查物质的性质,难度不大.把握物质的个性是解题的关键.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
15.丙烷是一种重要的烷烃,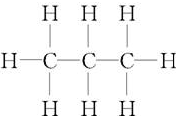 表示其( )
表示其( )
 表示其( )
表示其( )| A. | 结构简式 | B. | 结构式 | C. | 电子式 | D. | 分子式 |
13.Na2O2、CaC2都能与水反应,且反应中都有气体放出.下列说法正确的是( )
| A. | 都属于氧化还原反应 | B. | 生成的气体均为氧化产物 | ||
| C. | 反应物水均作氧化剂 | D. | 反应均放热 |
17.请以FeSO4溶液、KI溶液、氯水为试剂探究Fe2+和I-的还原性强弱.
①提出假设:假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+
②设计实验方案,写出实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液.
①提出假设:假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+
②设计实验方案,写出实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液.
| 实 实验步骤 | 预期现象与结论 |
| 步步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加再滴加几滴氯水. | 溶 溶液变成黄色,推测有Fe3+或I2生成. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液 | 溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+ |
15.有①纤维素;②环己烷;③苯;④乙酸;取等质量的上述有机物分别在过量氧气中完全燃烧,其中耗氧量由大到小排列顺序正确的是( )
| A. | ①②③④ | B. | ②③①④ | C. | ④①③② | D. | ③④①② |
 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W .
.

 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.