题目内容
3.过氧化氢(H2O2)的相对分子质量是( )| A. | 18 | B. | 20 | C. | 34 | D. | 8 |
分析 根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
解答 解:相对分子质量为构成分子的各原子的相对原子质量之和,H2O2的相对分子质量=1×2+16×2=34.
故选C.
点评 本题考查学生分子量的计算,注意相对分子质量为构成分子的各原子的相对原子质量之和即可解答,较简单.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
9.现在四种离子晶体,其离子排列方式如图所示,其中化学式正确的是( )
| A. |  AB2 AB2 | B. |  EF2 EF2 | C. |  XY3Z XY3Z | D. |  AB3 AB3 |
10.下列叙述中,正确的是( )
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 化合物变为单质时,化合价变化的元素一定被还原 | |
| D. | 油锅着火时,立即用水扑灭 |
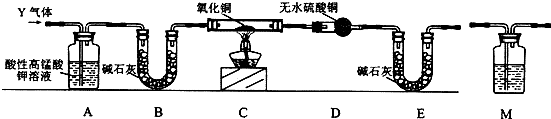
7. 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制氧气 |
14.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,5.6L 四氯化碳含有的分子数为0.25NA | |
| B. | 标准状况下,14g 氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA | |
| D. | 常温常压下,22.4L CO2中含有NA个CO2分子 |
8. 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,该图中有两处未画出,它们是①环形玻璃搅棒,②硬纸板(盖板).若没有这两个装置会造成最高温度读数偏小(填“增大”、“减小”或“无影响”);测得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).
(2)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会偏高(填偏高、偏低、或不变),其原因是由于浓硫酸溶于水放热.
(3)已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18kJ/(Kg•K),根据下表求出该反应的中和热为△H=-51.832kJ/mol (中和热:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热).
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,该图中有两处未画出,它们是①环形玻璃搅棒,②硬纸板(盖板).若没有这两个装置会造成最高温度读数偏小(填“增大”、“减小”或“无影响”);测得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.3 | 3.2 |
(3)已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18kJ/(Kg•K),根据下表求出该反应的中和热为△H=-51.832kJ/mol (中和热:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热).