题目内容
短周期元素Q、R、T、W在元素周期表中的位置如表所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为 .
(2)元素的非金属性为(原子的得电子能力):Q R(填“强于”或“弱于”).
(3)T的最高价氧化物对应水化物与NaOH反应的离子方程式
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 .
| Q | R | ||
| T | W |
(2)元素的非金属性为(原子的得电子能力):Q
(3)T的最高价氧化物对应水化物与NaOH反应的离子方程式
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,则Q是C元素、R是N元素、W是S元素,再结合原子结构、元素周期律、物质的性质分析解答.
解答:
解:根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,则Q是C元素、R是N元素、W是S元素,
(1)T是Al元素,其原子核外有3个电子层、最外层有3个电子,则其原子结构示意图为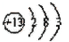 ,故答案为:
,故答案为: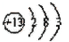 ;
;
(2)同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以Q的非金属性弱于R,故答案为:弱于;
(3)T的最高价氧化物对应水化物是Al(OH)3,Al(OH)3与NaOH溶液反应生成偏铝酸钠和水,所以二者反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)原子序数比R多1的元素是O元素,O元素的一种氢化物能分解为它的另一种氢化物,则该氢化物为双氧水,双氧水在二氧化锰作催化剂条件下分解生成水和氧气,反应方程式为2H2O2
2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑.
(1)T是Al元素,其原子核外有3个电子层、最外层有3个电子,则其原子结构示意图为
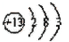 ,故答案为:
,故答案为: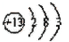 ;
;(2)同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以Q的非金属性弱于R,故答案为:弱于;
(3)T的最高价氧化物对应水化物是Al(OH)3,Al(OH)3与NaOH溶液反应生成偏铝酸钠和水,所以二者反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)原子序数比R多1的元素是O元素,O元素的一种氢化物能分解为它的另一种氢化物,则该氢化物为双氧水,双氧水在二氧化锰作催化剂条件下分解生成水和氧气,反应方程式为2H2O2
| ||
| ||
点评:本题考查了元素周期表和元素周期律的综合应用,明确元素周期表结构及元素在周期表中的位置是解本题关键,再结合物质的性质分析解答,知道氢氧化铝具有两性,能溶于强酸、强碱,题目难度不大.

练习册系列答案
相关题目
下列各项表达中正确的是( )
A、O2-的结构示意图为: |
| B、Mg2+的电子式:Mg2+ |
C、NaCl的电子式为:Na  |
| D、N2的结构式为::N≡N: |
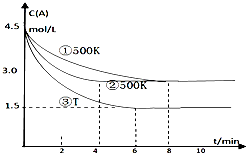 某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示.
某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示. 过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.