题目内容
10.两个化学兴趣小组进行了以下探究活动:第一组:为研究铁质材料与热浓硫酸的反应,
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中是否含有Fe2+,应选择加入的试剂为d(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取672mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g.据此推知气体Y 中SO2的体积分数为66.7%.
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).

(2)写出产生CO2的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)装置A中试剂的作用是除去混合气体中的SO2,反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)如果气体Y中含有H2,预计实验现象应是E中固体由黑变红和F中固体由白变蓝.
(5)简述确认气体Y中含有CO2的实验现象B中品红溶液不褪色,C中石灰水变浑浊.
第二组:拟用下列装置定量分析空气中SO2的含量:

注:气体流速管是用来测量单位时间内通过气体的体积的装置
(6)KMnO4溶液中导管末端做成球状多孔结构的作用是增大接触面积,有利于SO2的充分吸收.
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L.若从气体通入到紫色恰好褪去,用时5分钟.则此次取样处的空气中二氧化硫含量为$\frac{32bc}{a}$g/L.
分析 (1)①Fe2+具有还原性,可与高锰酸钾发生氧化还原反应;
②根据反应的方程式SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,利用关系式法解答;
(2)碳能和浓硫酸反应生成二氧化硫、二氧化碳和水;
(3)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,可用酸性高锰酸钾除去,为避免空气中水合二氧化碳进入F装置,G装置起到可吸收空气中的水和二氧化碳的作用;
(4)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色;
(5)确认气体Y中含有CO2,应完全排除二氧化硫的干扰,根据二氧化硫的漂白性解答;
(6)KMnO4溶液中导管末端做成球状多孔结构可以增大气体与溶液的接触,使气体充分被吸收;
(7)通入空气体积5aL,反应的KMnO4物质的量为bcmol,根据KMnO4物质的量运用方程式计算空气中二氧化硫的物质的量,进而计算空气中二氧化硫含量.
解答 解:(1)①溶液为Fe3+和Fe2+离子的混合物,加入KSCN溶液和氯水、铁粉和KSCN溶液、浓氨水都不能检验亚铁离子的存在,亚铁离子具有还原性,高锰酸钾溶液呈紫色,具有氧化性,可与亚铁离子在酸性条件下反应二褪色,
故答案为:d;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,
所以硫酸钡和二氧化硫之间的关系式为SO2-----BaSO4,
设二氧化硫的体积为V,
SO2-----BaSO4,
22.4L 233g
V 4.66g
V=0.448l=448mL,所以二氧化硫的体积分数=$\frac{448mL}{672mL}$×100%=66.7%,
故答案为:66.7%;
(2)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
故答案为:除去混合气体中的SO2;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,
故答案为:E中黑色固体变红色,F中无水硫酸铜由白色变蓝色;
(5)确认气体Y中含有CO2,应完全排除二氧化硫的干扰,当B中品红溶液不褪色,C中石灰水变浑浊,可说明含有CO2,
故答案为:B中品红溶液不褪色,C中石灰水变浑浊;
(6)KMnO4溶液中导管末端做成球状多孔结构可以增大气体与溶液的接触,有利于SO2的充分吸收.
故答案为:增大接触面积,有利于SO2的充分吸收;
(7)通入空气体积a L/min×5min=5aL,KMnO4物质的量为bL×cmol/L=bcmol,
5SO2+2KMnO4+2H2O=2H2SO4+2MnSO4+K2SO4
5 2
n(SO2) bcmol
所以 n(SO2)=$\frac{5}{2}$bcmol,质量为 $\frac{5}{2}$bcmol×64g/mol=160bcg,
此次取样处的空气中二氧化硫含量为$\frac{160bcg}{5aL}$=$\frac{32bc}{a}$g/L.
故答案为:$\frac{32bc}{a}$.
点评 本题考查了元素及其化合物的性质及实验设计、探究物质的组成和含量,为高频考点,综合性较强,难度较大,掌握浓硫酸、二氧化硫等物质的性质是关键,平时学习中加强离子方程式的书写及计算能力的培养.

| A. | 在Na2CO3溶液中一定有:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| B. | 在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 在NH4Cl溶液中一定有:c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 在CH3COONa溶液中一定有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |

| A. | 图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 | |
| B. | 图①中使用的NaOH的浓度为2 mol/L | |
| C. | 图②表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| D. | 图③中曲线表示3H2(g)+N2(g)═2NH3(g)反应过程的能量变化.若使用催化剂,B点会降低 |
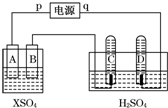 如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:(1)p为正极,A极发生了氧化反应.
(2)左侧装置在工业上的应用电镀或粗铜精炼(写出一个即可).
(3)C为阳极,C极的电极反应式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体 体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
| 体积(cm3) |
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为64 g/mol.
| A. | 滴水成冰 | B. | 死灰复燃 | C. | 积土成堆 | D. | 立竿见影 |
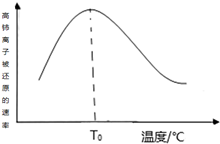 高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.
高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.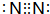 .
.