题目内容
下燃烧0.1mol两种气态烃的混合物,生成3.58L CO2(标准状况)和3.60g H2O,则混合气体中( )
| A、一定有甲烷 |
| B、一定有乙烷 |
| C、一定无甲烷 |
| D、一定有丙烷 |
考点:有关有机物分子式确定的计算
专题:计算题,烃及其衍生物的燃烧规律
分析:n(CO2)=
=0.16mol,n(H2O)=
=0.2mol,则混合的平均化学式为C1.6H4,因是混合物,则肯定含有C原子数小于1.6的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此解答该题.
| 3.58L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |
解答:
解:n(CO2)=
=0.16mol,n(H2O)=
=0.2mol,则混合的平均化学式为C1.6H4,因是混合物,则肯定含有C原子数小于1.6的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,乙烷、丙烷中H原子数目都大于4,不可能含有,
故选A.
| 3.58L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |
故选A.
点评:本题考查分子式的确定、混合物计算,题目难度中等,关键是利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

练习册系列答案
相关题目
质量分数为a的KOH溶液mg与质量分数为b的该溶液mg混合后,得到KOH物质的量浓度为c mol/L的混合溶液.则所得混合溶液的密度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列四组溶液,不用其他试剂就能鉴别开来的是( )
①AgNO3溶液、稀氨水
②NaAlO2、KHCO3、NaCl、NaHSO4
③HNO3、Na2SO3、Na2SO4、BaCl2
④AlCl3、NaAlO2.
①AgNO3溶液、稀氨水
②NaAlO2、KHCO3、NaCl、NaHSO4
③HNO3、Na2SO3、Na2SO4、BaCl2
④AlCl3、NaAlO2.
| A、① | B、①②④ | C、①②③ | D、全部 |
燃烧下列混合气体,所产生的CO2的量一定小于燃烧相同质量的丙烯所产生的CO2的是( )
| A、丁烯、丙烯 |
| B、乙炔、乙烯 |
| C、乙炔、丙烷 |
| D、乙烯、丙烷 |
下列有机物的命名,正确的是( )
| A、2,3,3,8,8-五甲基壬烷 |
| B、2,2,7,7,8-五甲基壬烷 |
| C、2,3,3,5,5-五甲基戊烷 |
| D、2,2,4,4,5-五甲基戊烷 |
一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )
| A、c(M-)≥c(NH4+) |
| B、c(A-)≤c(M+) |
| C、若MA不水解,则c( OH-)<c(A-) |
| D、若MA水解,则c( OH-)>c(A-) |
关于下列各实验装置的叙述中,不正确的是( )
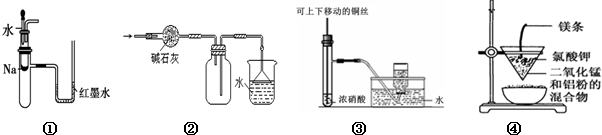

| A、装置①可用于验证Na与H2O反应是否放热 |
| B、装置②可用于干燥、收集NH3,并吸收多余的NH3 |
| C、装置③可用于制备并收集少量NO2 |
| D、装置④可制得金属锰 |
 科学家最近在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键),下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键),下列说法正确的是( )| A、X是一种在常温下能稳定存在的液态烃 |
| B、X能使溴的四氯化碳溶液褪色 |
| C、X分子中在同一平面上的碳原子最多5个 |
| D、X的一氯取代物有四种 |