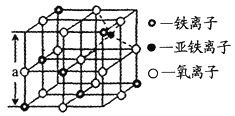
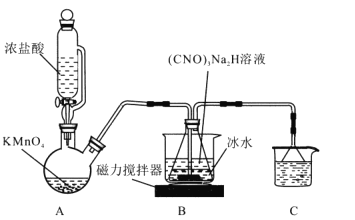
题目内容
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)相同质量的CO和CO2,它们所含的原子数之比为___________,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____________。
(2)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(3)标准状况下有①0.112 L水 ②0.5NA个HCl分子 ③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne 所含原子个数从大到小的顺序为___________。
(4)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出![]() mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
【答案】22:21 2:1 ![]() ①⑤③②④
①⑤③②④ ![]() mol/L
mol/L
【解析】
(1)设CO和CO2的质量相同,根据m=nM,物质的量和摩尔质量成反比,所以它们的物质的量之比为44:28=11:7,所含的原子数之比为11×2:7×3=22:21。CO和CO2所含的氧原子数相同,则它们的分子数之比即物质的量之比为2:1,标准状况下,物质的量和体积成正比,故CO和CO2的体积比为2:1。
(2)若a g某气体中含有的分子数为b,则c g该气体含有的分子数为![]() ,物质的量为
,物质的量为![]() =
=![]() mol,在标准状况下的体积是
mol,在标准状况下的体积是![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L。
L。
(3)①0.112 L水的质量为112g,物质的量为6.2mol,原子的物质的量为6.2×3=18.6mol;
②0.5NA个HCl分子的物质的量为0.5mol,原子的物质的量为1mol;
③25.6 g SO2气体的物质的量为![]() =0.4mol,原子的物质的量为1.2mol;
=0.4mol,原子的物质的量为1.2mol;
④0.2 mol氨气(NH3)中所含原子的物质的量为0.8mol;
⑤2 mol Ne 所含原子的物质的量为2mol;
所以所含原子个数从大到小的顺序为①⑤③②④。
(4)n(Fe3+)=![]() mol,在Fe2(SO4)3中n(SO42-)=1.5n(Fe3+)=
mol,在Fe2(SO4)3中n(SO42-)=1.5n(Fe3+)=![]() mol,从V mL Fe2(SO4)3溶液中取出的
mol,从V mL Fe2(SO4)3溶液中取出的![]() mL溶液中n(SO42-)=
mL溶液中n(SO42-)=![]() mol,稀释至4V mL,溶液中SO42-的物质的量浓度为
mol,稀释至4V mL,溶液中SO42-的物质的量浓度为 =
=![]() mol/L。
mol/L。

【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:
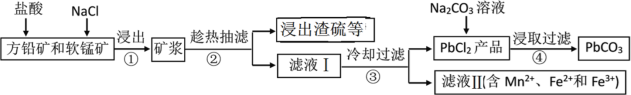
已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
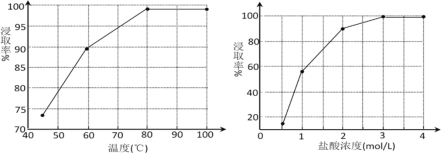
(2)步骤①中MnO2的作用是________,根据下图分析过程①的最佳反应条件是_________。
(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Ⅱ先酸化,然后加入MnO2,反应的离子方程式为________;若反应后![]() ,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________
,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________![]() 时表示Fe3+已沉淀完全]。
时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。