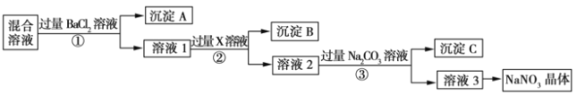
题目内容
【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:
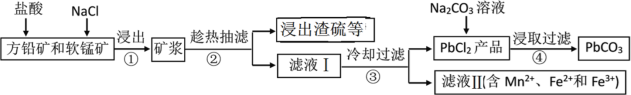
已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
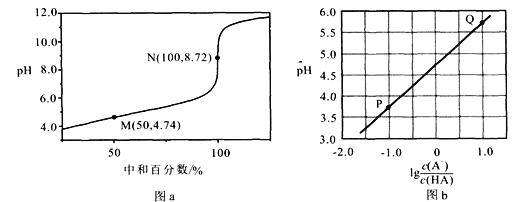
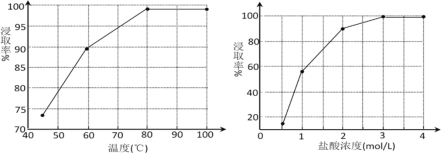
(2)步骤①中MnO2的作用是________,根据下图分析过程①的最佳反应条件是_________。
(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Ⅱ先酸化,然后加入MnO2,反应的离子方程式为________;若反应后![]() ,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________
,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________![]() 时表示Fe3+已沉淀完全]。
时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。
【答案】碳酸铅 氧化剂(将难溶的PbS转化为S和PbCl2) 80℃和3mol/LHCl PbCl2降温易结晶析出,趁热抽滤有利于铅的化合物与不溶性杂质分离 冷水或乙醇 ![]() 3≤pH<8
3≤pH<8 ![]()
【解析】
根据流程:方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)加入盐酸、NaCl主要发生反应:MnO2+PbS+4HCl=PbCl2+MnCl2+S+2H2O,浸出,趁热过滤,得到含有S的浸出渣,滤液I含有PbCl2、MnCl2、FeCl2、FeCl3等,冷却过滤得到PbCl2,将其与碳酸钠溶液反应,发生沉淀转化可得产品PbCO3,滤液II含有Mn2+、Fe2+、Fe3+,将滤液Ⅱ先酸化,然后加入MnO2,氧化Fe2+,调节溶液的pH沉淀Fe3+,可分离出Fe3+和Mn2+,据此分析作答。
(1)PbCO3的名称是碳酸铅;
(2)根据流程,加入二氧化锰得到S,故MnO2的作用是氧化剂(将难溶的PbS转化为S和PbCl2);根据图可知,80℃和3mol/LHCl时,浸取率最高,温度再高或者盐酸浓度再高,浸取率变化不明显,故80℃和3mol/LHCl为最佳条件;
(3)已知PbCl2易溶于热水,故步骤②趁热抽滤的原因是PbCl2降温易结晶析出,趁热抽滤有利于铅的化合物与不溶性杂质分离;
(4)已知PbCl2难溶于冷水和乙醇,故步骤③洗涤用的试剂是冷水或乙醇,以降低氯化铅的溶解损耗;
(5)滤液II含有Mn2+、Fe2+、Fe3+,先酸化然后加入MnO2可氧化Fe2+生成Fe3+,反应为:2Fe2++4H++MnO2=2Fe3++Mn2++2H2O;已知:Ksp[Fe(OH)3]=1×10-38,则Fe3+完全沉淀时,c(OH-)=![]() =mol/L=10-11mol/L,则c(H+)=10-3mol/L,pH=3,又Ksp[Mn(OH)2]=2×10-13,c(Mn2+)=0.2mol/L,则Mn2+刚开始沉淀时c(OH-)=
=mol/L=10-11mol/L,则c(H+)=10-3mol/L,pH=3,又Ksp[Mn(OH)2]=2×10-13,c(Mn2+)=0.2mol/L,则Mn2+刚开始沉淀时c(OH-)=![]() mol/L=10-6mol/L,则c(H+)=10-8mol/L,pH=8,故为Fe3+完全沉淀而不使Mn2+沉淀,pH范围为:3≤pH<8;
mol/L=10-6mol/L,则c(H+)=10-8mol/L,pH=8,故为Fe3+完全沉淀而不使Mn2+沉淀,pH范围为:3≤pH<8;
(6)根据表格数据可知PbCl2的溶度积要比PbCO3的溶度积大得多,所以虽然为不同种类型的沉淀,也可知PbCO3的溶解度较小,所以PbCl2与碳酸钠溶液混合使PbCl2转化为PbCO3,离子方程式为:PbCl2(S)+CO32-(aq)=PbCO3(S)+2Cl-(aq)。