题目内容
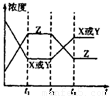
 如图所示,对于反应:X(g)+Y(g)═2Z(g);△H<0,如果反应开始经t1秒后达平衡,又经t2秒后,由于条件改变,原平衡破坏,到t3秒时又建立新的平衡,则t2到t3曲线变化的原因是( )
如图所示,对于反应:X(g)+Y(g)═2Z(g);△H<0,如果反应开始经t1秒后达平衡,又经t2秒后,由于条件改变,原平衡破坏,到t3秒时又建立新的平衡,则t2到t3曲线变化的原因是( )分析:从t2秒后X或Y的浓度增大,Z的浓度减小,说明平衡向逆反应方向移动,根据反应的特点和外界条件对平衡的影响来判断.
解答:解:A、t2到t3X或Y的浓度增大,Z的浓度减小,若增大了X或Y的浓度,平衡向正反应方向移动,Z的浓度应增大,不符合,故A错误;
B、使用了催化剂,平衡不移动,X、Y、Z的浓度应不变,故B错误;
C、增大了体系压强,平衡不移动,X、Y、Z的浓度应增大,故C错误;
D、该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象符合,故D正确.
故选D.
B、使用了催化剂,平衡不移动,X、Y、Z的浓度应不变,故B错误;
C、增大了体系压强,平衡不移动,X、Y、Z的浓度应增大,故C错误;
D、该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象符合,故D正确.
故选D.
点评:本题考查化学平衡的影响因素,题目难度不大,注意化学方程式的前后计量数的关系以及反应放热的特点,以此判断影响平衡移动的因素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 某学生用优质大理石与稀盐酸反应制取CO2,实验结果如图所示,对于该图的叙述正确的是( )
某学生用优质大理石与稀盐酸反应制取CO2,实验结果如图所示,对于该图的叙述正确的是( ) 瘦肉精(Clenbuterol)是一种非常廉价的药品,但它有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病.瘦肉精是白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构如图所示,对于瘦肉精的说法正确的是( )
瘦肉精(Clenbuterol)是一种非常廉价的药品,但它有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病.瘦肉精是白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构如图所示,对于瘦肉精的说法正确的是( )