题目内容
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 23g Na与足量H2O反应完全后可生成0.5NA个H2分子 | |
| C. | 2 L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
分析 A、求出二氧化碳的物质的量,然后根据当1mol二氧化碳参与反应时,反应转移1mol电子来分析;
B、求出钠的物质的量,然后根据1molNa~0.5molH2来计算;
C、2 L0.5mol•L-1硫酸钾溶液中的阴离子除了硫酸根外,还有氢氧根;
D、标况下苯为液态.
解答 解:A、标况下5.6L二氧化碳的物质的量为0.25mol,而当1mol二氧化碳参与反应时,反应转移1mol电子,故0.25mol二氧化碳反应时,反应转移0.25mol电子,即0.25NA个,故A错误;
B、23g钠的物质的量为1mol,而1molNa~0.5molH2,故1mol钠生成0.5mol氢气即0.5NA个氢气分子,故B正确;
C、2 L0.5mol•L-1硫酸钾溶液中的阴离子除了硫酸根外,还有氢氧根,故溶液中阴离子所带电荷数大于NA个,故C错误;
D、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
13.从氧化还原反应的角度看,在实验室制取①H2 ②CO2 ③Cl2的三个反应中,盐酸的作用( )
| A. | 互不相同 | B. | 在①和②中相同 | C. | 在②和③中相同 | D. | 在①②③中均相同 |
14.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末;有气泡产生,说明氯水中含有H+ | |
| D. | 氯水中加入氢氧化钠溶液,氯水的黄绿色消失,说明氯水中含有HClO |
12.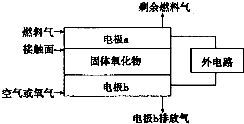 已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.
已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
通过分析上表,金属锌与某浓度的硝酸反应时,若无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是1:10.
(2)以氨作为燃料的固体氧化物(含有O2-,接触面可让O2-通过)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示
①负极为a(选填“a”或“b”).
②该电池工作时的总反应为4NH3+3O2=2N2+6H2O.
③固体氧化物作为电池工作的电解质,O2-移动方向为由电极b向电极a移动(选填“由电极a向电极b”或“由电极b向电极a”).
④该电池工作时,在图中所给的接触面上发生的电极反应为:2NH3+3O2--6e-=N2+3H2O.
 已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.
已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
| 硝酸 | 硝酸浓度大于10mol/L | 硝酸浓度为6.6~10mol/L、加热 | 硝酸浓度为6.6~10mol/L |
| 还原产物 | NO2 | NO2 | NO2 |
| 硝酸 | 硝酸浓度为0.1~6.6mol/L、加热 | 硝酸浓度0.1~6.6mol/L | 硝酸浓度0.1mol/L |
| 还原产物 | NO | NO2、N2 | NH4NO3 |
(2)以氨作为燃料的固体氧化物(含有O2-,接触面可让O2-通过)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示
①负极为a(选填“a”或“b”).
②该电池工作时的总反应为4NH3+3O2=2N2+6H2O.
③固体氧化物作为电池工作的电解质,O2-移动方向为由电极b向电极a移动(选填“由电极a向电极b”或“由电极b向电极a”).
④该电池工作时,在图中所给的接触面上发生的电极反应为:2NH3+3O2--6e-=N2+3H2O.
16.下列过程吸收热量的是( )
| A. | 镁条溶于盐酸 | B. | 粉尘爆燃 | C. | 生石灰溶于水 | D. | 液氨气化 |
17.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 明矾是常用的水处理剂,可以淡化海水 | |
| B. | 中国新型“鹘鹰”战斗机上使用的碳纤维是一种新型无机高分子材料 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 葡萄酒中常添加极少量SO2,有防止葡萄酒氧化变质等作用 |