题目内容
 乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示.利用标签提供的信息,回答下列问题:
乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示.利用标签提供的信息,回答下列问题:(1)乙酸的摩尔质量为
(2)若该乙酸溶液的密度为1.02g/cm3,求此乙酸溶液的物质的量浓度.(写出计算过程,结果精确到0.01)
(3)用此酸配制250mL2mol/L的稀乙酸,需要这种乙酸的体积是多少.(写出计算过程)
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)摩尔质量以g/mol为单位,数值上等于其相对分子质量;
(2)根据c=
计算;
(3)根据稀释定律计算需要乙酸的体积.
(2)根据c=
| 1000ρω |
| M |
(3)根据稀释定律计算需要乙酸的体积.
解答:
解:(1)乙酸的结构简式为CH3COOH,其相对分子质量为12×2+4+16×2=60,则其摩尔质量以g/mol,故答案为:60g/mol;
(2)乙酸溶液的密度为1.02g/cm3,质量分数为36%,根据c=
可知,c(乙酸)=
mol/L=6.12mol/L,
答:这种乙酸的物质的量浓度为6.12mol/L;
(3)设需要该乙酸的体积为V,根据稀释定律,溶液配制前后溶质的物质的量相等,则:
250mL×2mol/L=V×6.12mol/L
解得V=81.7mL
答:需要该乙酸的体积为81.7mL.
(2)乙酸溶液的密度为1.02g/cm3,质量分数为36%,根据c=
| 1000ρω |
| M |
| 1000×1.02×36% |
| 60 |
答:这种乙酸的物质的量浓度为6.12mol/L;
(3)设需要该乙酸的体积为V,根据稀释定律,溶液配制前后溶质的物质的量相等,则:
250mL×2mol/L=V×6.12mol/L
解得V=81.7mL
答:需要该乙酸的体积为81.7mL.
点评:本题考查物质的量浓度有关计算,注意对公式的理解与灵活应用,注意理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
可逆反应mA(气)+nB?pC(气)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
| A、增大压强,平衡不移动,说明(m+n)一定等于(p+q) |
| B、升高温度,A的转化率减小,说明正反应是吸热反应 |
| C、若增加B的量,平衡体系颜色加深,说明B必是气体物质 |
| D、若B是气体,增加A的量,A、B转化率都一定增大 |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
| ||
| A、H2SO4是氧化剂 |
| B、ClO2是氧化产物 |
| C、H2C2O4在反应中被氧化 |
| D、1 molKClO3参加反应有2mol电子转移 |
体积均为200mL浓度均为1mol/L的稀盐酸和氢氧化钠溶液中分别加入相同质量的铝,充分反应后生成气体在相同条件下的体积比为2:3.则下列说法正确的是( )
| A、盐酸过量,氢氧化钠不足 |
| B、氢氧化钠过量,盐酸不足 |
| C、两容器中投入的铝的质量为2.7g |
| D、条件不足,无法判断 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、2.8g乙烯中含有共价键的数目为0.5NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
下列关于晶体的说法一定正确的是( )
| A、分子晶体中都存在共价键 |
| B、金属晶体的熔点都比分子晶体的熔点高 |
| C、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
D、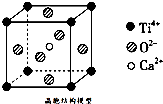 某物质晶胞结构如图,该物质的化学式为CaTiO3(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) |
下列说法正确的是( )
| A、可用丁达尔效应区分胶体与溶液 |
| B、生石灰与水混合过程只发生物理变化 |
| C、臭氧是由三个氧原子构成的化合物 |
| D、CuSO4?H2O是一种混合物 |
