题目内容
8. 甲醇是一种新型的能源.
甲醇是一种新型的能源.(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)H=-443.5kJ•mol-1;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇.在其他条件不变的情况下,考查温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
下列说法正确的是AB(填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=nA/tA (mol•L-1•min-1)
B.该反应在T1时的平衡常数比T2时的大
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时n(H2)n(CH3OH)减小
(4)在T1温度时,将1mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比为(3-2a):3;
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为CH3OH-6e-+8OH-═CO32-+6H2O;假设原电解质为NaOH,且电池工作一段时间后溶质只有Na2CO3,此时溶液中各离子浓度大小关系为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
分析 (1)据原子守恒和得失电子守恒书写焦炭和水在高温下制取合成气(组成为H2和CO)的化学方程式;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)①A、反应速率是反应中某物质的浓度在单位时间内的变化,据此可判断;
B、根据反应CO(g)+2H2(g)?CH3OH(g)的热量的变化,并由此判断温度变化时平衡移动的方向,再判断平衡常数的变化;
C、根据温度的变化对平衡的影响,判断平衡移动的方向,再据此判断;
D、根据温度变化后对生成物的物质的量的影响,可判断平衡移动方向;
(4)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来解答;
(5)根据原电池中负极发生氧化反应,正极发生还原反应,并考虑电解质溶液参与电极反应来分析;碳酸钠溶液中碳酸根离子水解溶液呈碱性,碳酸根离子分步水解;
解答 解:(1)据原子守恒和得失电子守恒书写焦炭和水在高温下制取合成气(组成为H2和CO)的化学方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)①A、反应速率是反应中某物质的浓度在单位时间内的变化,v(CH3OH)=$\frac{{n}_{A}}{{t}_{A}}$(mol•L-1•min-1),故A正确;
B、根据反应CO(g)+2H2(g)?CH3OH(g)是放热反应可知,升高温度,平衡向逆反应方向移动,该反应在T1时的平衡常数比T2时的大,故B正确;
C、T2>T1,T2平衡时,甲醇产量变少,则说明可逆反应CO+2H2?CH3OH向逆反应方向移动,故正反应为放热反应,故C错误;
D、处于A点的反应体系从T1变到T2,升高温度,甲醇的物质的量减小,平衡向逆反应方向移动,$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,故D错误;
故答案为:AB;
(4)在T1温度时,将1mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,由化学平衡的三段模式法计算可知,气体压强之比等于气体物质的量之比,
CO (g)+2H2(g)=CH3OH(g)
起始 1 2 0
变化 a 2a a
平衡 1-a 2-2a a
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为=(1-a+2-2a+a):(1+2)=(3-2a):3,
故答案为:(3-2a):3;
(5)由燃料电池是原电池的一种,负极失电子发生氧化反应,正极得电子发生还原反应,甲醇燃烧生成二氧化碳和水,
但在碱性介质中,正极有氢氧根离子参与反应,甲醇燃料电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;Na2CO3溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液呈碱性,溶液中离子浓度大小为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+);
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+);
点评 本题考查范围广,考查了平衡移动、平衡计算、电化学、离子浓度大小比较等知识,掌握基础是关键,题目难度大.

| A. | 废旧电池应集中回收处理 | |
| B. | 充电电池放电时,化学能转变为电能 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
| A. | 恒压时,通入HI气体,刚开始时正反应速率会减小 | |
| B. | 恒温时,减小容积,平衡不移动,但气体颜色加深 | |
| C. | 恒容时,通入H2,I2的质量分数减小 | |
| D. | 恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小 |

(1)已知元素周期表中的各周期可排元素种类如下:
| 周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有23种非金属元素,还有1种未发现.未发现的非金属元素处于七周期0族.
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
回答下列问题:
①请在图中将过渡元素所在的位置涂黑.
②画出B元素价电子排布图
 .
. | 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为:
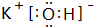 .
.(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.