题目内容
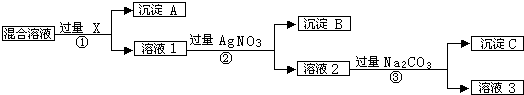
Ag/a-Al2O3是石油化工的一种重要催化剂,其中Ag起催化作用,a-Al2O3是载体且不溶于硝酸.某实验室将该催化剂回收的流程如图所示:
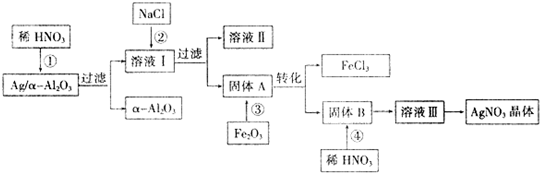
请完成下列问题:
(1)写出反应①的离子方程式 ;α-Al2O3与普通Al2O3相比,不溶于酸的原因可能是 .
(2)写出反应③的化学方程式 ;溶液I和溶液Ⅲ中溶质的主要成分相同,请分析设计从溶液I转化到溶液Ⅲ的目的是 .
(3)从溶液Ⅲ到AgNO3晶体的操作为:在硝酸的气氛中, 、 ,过滤、洗涤、干燥,然后转移至 的广口瓶中保存.
(4)已知Ag/α-Al2O3中Ag的质量分数,计算Ag的回收率,还必须测量的数据为 和 .

请完成下列问题:
(1)写出反应①的离子方程式
(2)写出反应③的化学方程式
(3)从溶液Ⅲ到AgNO3晶体的操作为:在硝酸的气氛中,
(4)已知Ag/α-Al2O3中Ag的质量分数,计算Ag的回收率,还必须测量的数据为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:根据流程可知,由于α-Al2O3不溶于稀硝酸,Ag/a-Al2O3中加入稀硝酸后银溶解生成硝酸银进入滤液Ⅰ,滤渣为α-Al2O3;向滤液Ⅰ中加入氯化钠,反应生成氯化银沉淀,则固体A为AgCl;氯化银与氧化铁发生反应:6AgCl+Fe2O3=3Ag2O+2FeCl3,则固体B为Ag2O,氧化银与稀硝酸反应生成硝酸银,滤液Ⅲ为硝酸银溶液,对滤液Ⅲ通过蒸发浓缩、冷却结晶得到硝酸银固体,
(1)银与稀硝酸反应生成硝酸银、一氧化氮和水,据此写出反应的离子方程式;结构决定性质,据此判断α-Al2O3不溶于稀硝酸原因;
(2)根据流程可知,氯化银与氧化铁反应生成氧化银和氯化铁;溶液I中硝酸银浓度较小,溶液Ⅲ中硝酸银浓度较大,据此分析实验目的;
(3)硝酸容易分解,银离子容易水解,则需要在浓硝酸的气氛中蒸发浓缩、冷却结晶、过滤、洗涤、干燥从而得到硝酸银固体;
(4)已知催化剂中银的质量分数,计算银的回收率,还必须知道催化剂的质量和硝酸银的质量.
(1)银与稀硝酸反应生成硝酸银、一氧化氮和水,据此写出反应的离子方程式;结构决定性质,据此判断α-Al2O3不溶于稀硝酸原因;
(2)根据流程可知,氯化银与氧化铁反应生成氧化银和氯化铁;溶液I中硝酸银浓度较小,溶液Ⅲ中硝酸银浓度较大,据此分析实验目的;
(3)硝酸容易分解,银离子容易水解,则需要在浓硝酸的气氛中蒸发浓缩、冷却结晶、过滤、洗涤、干燥从而得到硝酸银固体;
(4)已知催化剂中银的质量分数,计算银的回收率,还必须知道催化剂的质量和硝酸银的质量.
解答:
解:根据流程可知,α-Al2O3不溶于稀硝酸,Ag/a-Al2O3中加入稀硝酸后银溶解生成AgNO3进入滤液Ⅰ,滤渣为α-Al2O3;向滤液Ⅰ中加入NaCl,反应生成AgCl沉淀,则固体A为AgCl;AgCl与Fe2O3发生反应:6AgCl+Fe2O3=3Ag2O+2FeCl3,则固体B为Ag2O,Ag2O与稀硝酸反应生成AgNO3,滤液Ⅲ为AgNO3溶液,对滤液Ⅲ通过蒸发浓缩、冷却结晶得到AgNO3固体,
(1)Ag与稀硝酸反应生成硝酸银、一氧化氮和水,反应的离子方程式为:3Ag+NO3-+4H+=NO↑+3Ag++2H2O;
不同结构具有不同的性质,α-Al2O3与普通Al2O3相比,不溶于酸的原因可能是α-Al2O3与普通Al2O3结构不同,
故答案为:3Ag+NO3-+4H+=NO↑+3Ag++2H2O;α-Al2O3与普通Al2O3结构不同;
(2)根据流程可知,氯化银与氧化铁反应生成氯化铁和氧化银,反应的化学方程式为:6AgCl+Fe2O3=3Ag2O+2FeCl3;
溶液I中硝酸银浓度较小,溶液Ⅲ中硝酸银浓度较大,所以从溶液I转化到溶液Ⅲ的目的是除杂质且富集AgNO3,
故答案为:6AgCl+Fe2O3=3Ag2O+2FeCl3;去除杂质且富集AgNO3;
(3)从溶液Ⅲ到AgNO3晶体的操作为:在硝酸的气氛中蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥获得硝酸银固体;由于硝酸银容易见光分解,需要避光保存,即:将硝酸银保存在棕色广口瓶中,
故答案为:蒸发浓缩;冷却结晶;避光或棕色;
(4)要计算Ag的回收率必须知道催化剂的质量,再由所给Ag的质量分数求出Ag的质量,另外要知道最后所得AgNO3的质量,
故答案为:催化剂的质量;AgNO3的质量.
(1)Ag与稀硝酸反应生成硝酸银、一氧化氮和水,反应的离子方程式为:3Ag+NO3-+4H+=NO↑+3Ag++2H2O;
不同结构具有不同的性质,α-Al2O3与普通Al2O3相比,不溶于酸的原因可能是α-Al2O3与普通Al2O3结构不同,
故答案为:3Ag+NO3-+4H+=NO↑+3Ag++2H2O;α-Al2O3与普通Al2O3结构不同;
(2)根据流程可知,氯化银与氧化铁反应生成氯化铁和氧化银,反应的化学方程式为:6AgCl+Fe2O3=3Ag2O+2FeCl3;
溶液I中硝酸银浓度较小,溶液Ⅲ中硝酸银浓度较大,所以从溶液I转化到溶液Ⅲ的目的是除杂质且富集AgNO3,
故答案为:6AgCl+Fe2O3=3Ag2O+2FeCl3;去除杂质且富集AgNO3;
(3)从溶液Ⅲ到AgNO3晶体的操作为:在硝酸的气氛中蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥获得硝酸银固体;由于硝酸银容易见光分解,需要避光保存,即:将硝酸银保存在棕色广口瓶中,
故答案为:蒸发浓缩;冷却结晶;避光或棕色;
(4)要计算Ag的回收率必须知道催化剂的质量,再由所给Ag的质量分数求出Ag的质量,另外要知道最后所得AgNO3的质量,
故答案为:催化剂的质量;AgNO3的质量.
点评:本题考查了物质制备方案的设计、化学实验基本操作方法的综合应用,题目难度中等,正确理解题干流程、明确反应原理为解答关键,注意掌握物质分离、提纯方法及化学实验基本操作方法的综合应用,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
雅琴的班主任王老师最近带了一副变色眼镜,有关这些玻璃知识说法正确的是( )
| A、钢化玻璃不是玻璃 |
| B、普通玻璃加入氧化钴会呈现红色 |
| C、加入氧化铅后制得的光学玻璃折光率高 |
| D、钢化玻璃比普通玻璃机械强度小 |