题目内容
3.近年来,科学家新发现了一些含有碳、氮、硫、铜元素的物质,回答下列问题.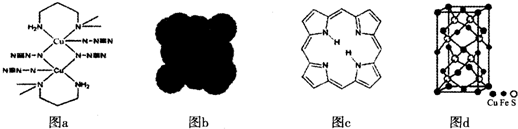
(1)电负性:C<N(填“>”或“<”).
(2)图a是某种铜盐配合物的结构,基态铜原子的价电子排布式为3d104s1,该配合物中铜元素的价态为+2.
(3)新的星际分子氰基辛四炔的结构为:H-C≡C-C≡C-C≡C-C≡C-C≡N,氰基辛四炔分子的构型为直线型;分子中σ键与π键数目之比为1:1.
(4)C60晶体(图b)中与每个C60紧邻的C60分子有12个;C60易溶于CS2溶剂中,原因是都是非极性分子,相似相溶;设C60晶胞边长为a pm,则C60晶体密度为$\frac{288}{{{N}_{A}a}^{3}×1{0}^{-31}}$g•cm-3.
(5)卟吩分子内存在氢键,在图c中用(…)画出氢键结构.
(6)写出图d中表示物质的化学式CuFeS2,该物质煅烧可冶炼铜,同时产生氧化亚铁,氧化铁和二氧化硫,且生成的氧化亚铁与氧化铁的物质的量之比为2:1,请写出反应的化学方程式8CuFeS2+25O2$\frac{\underline{\;高温\;}}{\;}$4FeO+2Fe2O3+16SO2+8CuO.
分析 (1)根据元素周期律,同一周期元素从左向右,电负性逐渐增大;
(2)铜是29号元素,根据能量最低原理写核外电子排布式,根据铜与氮的成键情况判断铜的化合价;
(3)氰基辛四炔的结构可以看成是由若干个乙炔的结构形成的,而乙炔所以原子都在一条件直线上,根据氰基辛四炔的结构可知分子中有4个碳碳三键、一个碳氮三键和5个单键,据此判断;
(4)C60晶体(图b)为面心立方结构,即C60分子分布在立方体的顶点和面心上,根据相似相溶原理解释C60易溶于CS2溶剂中,根据$ρ=\frac{m}{V}$计算晶体的密度;
(5)卟吩分子内氢键存在于氮原子和连在氮原子上的氢原子之间;
(6)根据均摊法计算出每个晶胞中含有的各原子数,进而确定化学式,根据元素守恒和电子得失守恒写化学方程式;
解答 解:(1)根据元素周期律,同一周期元素从左向右,电负性逐渐增大,所以电负性C<N,
故答案为:<;
(2)铜是29号元素,铜原子的核外价电子排布式为3d104s1,根据图a可知,铜的配位数为4,所以铜的化合价为+2价,
故答案为:3d104s1;+2;
(3)氰基辛四炔的结构可以看成是由若干个乙炔的结构形成的,而乙炔所以原子都在一条件直线上,所以氰基辛四炔的分子是直线型,根据氰基辛四炔的结构可知分子中有4个碳碳三键、一个碳氮三键和5个单键,每个三键中有两个π键和一个σ键,所以分子中σ键与π键数目之比为1:1,
故答案为:直线型;1:1;
(4)C60晶体(图b)为面心立方结构,即C60分子分布在立方体的顶点和面心上,每个C60紧邻的C60分子有12个,C60、CS2都是非极性分子,根据相似相溶原理可知,C60易溶于CS2溶剂中,在C60晶胞中,C60分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,所以$ρ=\frac{m}{V}$=$\frac{\frac{4×12×60}{{N}_{A}}g}{(apm)^{3}}$=$\frac{288}{{{N}_{A}a}^{3}×1{0}^{-31}}$g•cm-3,
故答案为:12;都是非极性分子,相似相溶;$\frac{288}{{{N}_{A}a}^{3}×1{0}^{-31}}$;
(5)卟吩分子内氢键存在于氮原子和连在氮原子上的氢原子之间,如图 ,
,
故答案为: ;
;
(6)根据均摊法可知,结构晶胞图可知,每个晶胞中含有的铜原子数为$8×\frac{1}{8}+4×\frac{1}{2}+1$=4,铁原子数为4×$\frac{1}{4}+6×\frac{1}{2}$=4,硫原子数为8,所以化学式为CuFeS2,该物质煅烧冶炼铜的化学方程式为8CuFeS2+25O2$\frac{\underline{\;高温\;}}{\;}$4FeO+2Fe2O3+16SO2+8CuO,
故答案为:CuFeS2;8CuFeS2+25O2$\frac{\underline{\;高温\;}}{\;}$4FeO+2Fe2O3+16SO2+8CuO;
点评 本题主要考查了电负性、核外电子排布、化学键、晶胞的结构、晶胞的计算等知识,难度较大,答题时注意观察晶胞的结构图.

| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO32- |
 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | 可用酚酞作该滴定的指示剂 | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时,c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 当滴定到pH=4.75时,c(A-)>c(Na+)>c(HA) | |
| D. | 当滴入40mL NaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:I.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-l
Ⅱ.CaO(s)+3CO(g)+SO2(g?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$({K}_{1}•{K}_{2})^{\frac{1}{2}}$(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
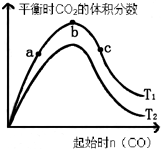
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应II
CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c.
②图象中T2高于T1(填“高于”、“低于”、“等于”或“无法确定”)判断的理由是反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1.
| A. | FeCl2 | B. | KHCO3 | C. | MgSO4 | D. | NH4HCO3 |
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸进行酸化 | |
| C. | 酒精与稀硫酸加热到170℃制乙烯 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |


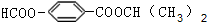 .
.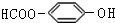 . (写结构简式)
. (写结构简式)