题目内容
下列关于碱金属的叙述错误的是( )
| A、碱金属中密度最小、熔沸点最高的是锂 |
| B、自上而下所形成的阳离子的氧化性依次减弱 |
| C、它们都能与水反应生成把氢气和碱 |
| D、它们都能在空气中燃烧生成M2O(M指碱金属) |
考点:碱金属的性质
专题:
分析:A.随核外电子层数递增,单质的密度呈增大的趋势,但K的密度比Na小,单质的沸点逐渐降低;
B.金属性越强的金属阳离子的氧化性越弱;
C.碱金属都能与水反应生成氢气和碱;
D.钠在空气中燃烧生成Na2O2.
B.金属性越强的金属阳离子的氧化性越弱;
C.碱金属都能与水反应生成氢气和碱;
D.钠在空气中燃烧生成Na2O2.
解答:
解:A.随核外电子层数递增,单质的密度呈增大的趋势,但K的密度比Na小,单质的沸点逐渐降低,所以碱金属中密度最小、熔沸点最高的是锂,故A正确;
B.碱金属的金属性随着原子序数的递增而逐渐增强,所以它们所形成的阳离子的氧化性随原子序数递增依次减弱,故B正确;
C.碱金属都能与水反应生成氢气和碱,故C正确;
D.锂在空气中燃烧生成Li2O,但钠在空气中燃烧生成Na2O2,故D错误;
故选D.
B.碱金属的金属性随着原子序数的递增而逐渐增强,所以它们所形成的阳离子的氧化性随原子序数递增依次减弱,故B正确;
C.碱金属都能与水反应生成氢气和碱,故C正确;
D.锂在空气中燃烧生成Li2O,但钠在空气中燃烧生成Na2O2,故D错误;
故选D.
点评:本题考查元素周期律的递变规律,题目难度不大,注意碱金属的密度变化,为易错点.

练习册系列答案
相关题目
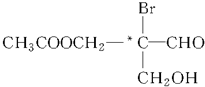 下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )
下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )| A、与乙酸发生酯化反应 |
| B、在稀硫酸作用下水解 |
| C、与银氨溶液作用发生银镜反应 |
| D、催化剂作用下与H2反应 |
下列离子方程式书写正确的是 ( )
| A、银氨溶液中加入足量盐酸产生沉淀[Ag(NH3)2]-+OH-+3H++Cl-═AgCl↓+2NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
| C、孔雀石可溶于盐酸 CO32-+2H+═CO2↑+H2O |
| D、氧化铁可溶于氢碘酸 Fe2O3+6H+═2Fe3++3H2O |
化学式为C5H12O的有机物,经测定知其分子中含有两个-CH3,两个-CH2-,一个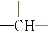 和一个-OH,则它们的可能结构有( )
和一个-OH,则它们的可能结构有( )
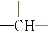 和一个-OH,则它们的可能结构有( )
和一个-OH,则它们的可能结构有( )| A、5种 | B、3种 | C、2种 | D、4种 |
关于污水的处理方法错误的是( )
| A、轧钢厂排出的废水主要是含盐酸的酸性废水,一般采用中和法处理 |
| B、油类、氰化物、硫化物等可以用氧化还原法除去 |
| C、沉淀法是除去废水中重金属离子的主要方法 |
| D、用明矾作为混凝剂可吸附除去水中所有杂质 |
在某无色透明的且能使石蕊试剂变红的溶液中,能大量共存的离子组是( )
| A、K+、SO42-、HCO3- |
| B、K+、SO42-、NO3- |
| C、Fe2+、Cl-、NO3- |
| D、Fe3+、ClO-、Cl- |
两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法错误的是( )
| A、若8>m>3,则X必定为主族元素 |
| B、若Y的气态氢化物化学式为YHn,且b=4,则该氢化物为非极性分子 |
| C、若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X |
| D、若a=b=3,8>m>n>b,则元素非金属性:X>Y |