题目内容
过氧化氢常用于消毒、杀菌、漂白等,是中学化学中的一种重要的试剂.
(1)一种制备过氧化氢的流程如图1,此过程的总化学方程式为 .
(2)质量分数为5%的H2O2水溶液(密度为1g?mL-1)的物质的量浓度为 .
(3)某实验小组设计下表3组实验研究溶液的酸碱性对H2O2分解反应速率的影响,绘制生成氧气的体积随时间变化的关系如图2.
分析该图能够得出的实验结论是 .
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应中MnO4-被还原为Mn2+.
①请用离子方程式表示该滴定原理 .
②准确量取20.00mL某过氧氢试样置于锥形瓶中,用0.1000mol?L-1的酸性KMnO4标准溶液滴定,平行滴定三次,消耗酸性KMnO4溶液的平均体积为18.00mL.则该试样中过氧化氢的浓度为 mol?L-1.

(1)一种制备过氧化氢的流程如图1,此过程的总化学方程式为
(2)质量分数为5%的H2O2水溶液(密度为1g?mL-1)的物质的量浓度为
(3)某实验小组设计下表3组实验研究溶液的酸碱性对H2O2分解反应速率的影响,绘制生成氧气的体积随时间变化的关系如图2.
| 实验编号 | 反应物(室温) | 催化剂 |
| a | 10mL5%H2O2溶液+1mLH2O | 0.1gMnO2粉末 |
| b | 10mL5%H2O2溶液+1mL稀HCl | 0.1gMnO2粉末 |
| c | 10mL5%H2O2溶液+1mL稀NaOH溶液 | 0.1gMnO2粉末 |
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应中MnO4-被还原为Mn2+.
①请用离子方程式表示该滴定原理
②准确量取20.00mL某过氧氢试样置于锥形瓶中,用0.1000mol?L-1的酸性KMnO4标准溶液滴定,平行滴定三次,消耗酸性KMnO4溶液的平均体积为18.00mL.则该试样中过氧化氢的浓度为

考点:化学反应速率的影响因素,化学方程式的有关计算
专题:
分析:(1)根据反应物和生成物结合反应历程判断;
(2)根据c=
计算;
(3)由图象可知,碱性条件下分解速率最大;
(4)①发生氧化还原反应生成氧气和Mn2+;
②根据反应的方程式计算.
(2)根据c=
| 1000ρω |
| M |
(3)由图象可知,碱性条件下分解速率最大;
(4)①发生氧化还原反应生成氧气和Mn2+;
②根据反应的方程式计算.
解答:
解:(1)通过图示可知,用乙基蒽醌作催化剂制取双氧水,反应的方程式为H2+O2
H2O2,故答案为:H2+O2
H2O2;
(2)c=
=
=1.47 mol/L,故答案为:1.47 mol/L;
(3)由图象可知,碱性条件下分解速率最大,可知保持其他条件不变,溶液的pH越大,双氧水分解速度越快,故答案为:保持其他条件不变,溶液的pH越大,双氧水分解速度越快;
(4)①发生氧化还原反应生成氧气和Mn2+,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;
②根据反应2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000mol?L-1×0.018L,c(H2O2)=
=0.225 mol/L,
故答案为:0.225 mol/L.
| ||
| ||
(2)c=
| 1000ρω |
| M |
| 1000×1g/L×5% |
| 34g/mol |
(3)由图象可知,碱性条件下分解速率最大,可知保持其他条件不变,溶液的pH越大,双氧水分解速度越快,故答案为:保持其他条件不变,溶液的pH越大,双氧水分解速度越快;
(4)①发生氧化还原反应生成氧气和Mn2+,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;
②根据反应2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000mol?L-1×0.018L,c(H2O2)=
| 2.5×0.1000×0.018 |
| 0.02 |
故答案为:0.225 mol/L.
点评:本题考查较为综合,涉及多方面知识,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,注意知识的归纳和梳理是解题的关键,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列说法正确的是( )
| A、在任何条件下,纯水都呈中性 |
| B、pH<7的溶液一定呈酸性 |
| C、25℃时,纯水和稀酸溶液中水的离子积常数不相符 |
| D、pH均等于6的NH4Cl溶液和CH2COOH溶液中,水的电离程度相同 |
下列根据实验现象所得出的结论中,错误的是( )
| A、向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- |
| B、无色溶液焰色反应呈黄色,结论:溶液中含有Na+ |
| C、向无色试液加入硝酸酸化的硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- |
| D、向某溶液中加入氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,结论:溶液中含有NH4+ |
某化合物由碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式可能是( )
| A、CH3CH2OCH3 |
| B、CH3COOH |
| C、CH3CH2CH2OH |
| D、CH3CH2CHO |
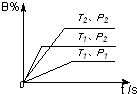 已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )| A、T1<T2,P1>P2,m+n>p,Q>0 |
| B、T1>T2,P1<P2,m+n>p,Q<0 |
| C、T1<T2,P1>P2,m+n<p,Q>0 |
| D、T1>T2,P1<P2,m+n<p,Q>0 |
今有一混合物的水溶液,只可能含有以下离子中的若干种(不考虑水的电离):K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到标准状况下气体896ml(气体全部逸出);(3)第三份加足量BaCl2溶液后,得干燥沉淀6.3g,经足量盐酸洗涤、干燥后,沉淀质量4.66g.根据上述实验,以下推测正确的是( )
| A、K+一定存在 |
| B、100 mL溶液中含0.02 mol CO32- |
| C、Cl-一定存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
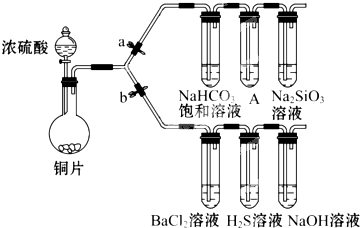 根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)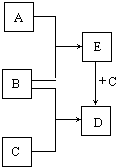 已知A、B、C是常见的单质,在一定条件下相互转化的关系如图所示(有部分物质省略)
已知A、B、C是常见的单质,在一定条件下相互转化的关系如图所示(有部分物质省略)