题目内容
20. 如图所示支管中,左管中放入KMnO4固体,右管中放入一小块钠,再向两管均加入适量8mol•L-1的盐酸,半分钟后,盖以橡胶塞并将此支管固定在铁架台上.用一照相机对准此支管,按快门,闪光灯闪亮.请回答:
如图所示支管中,左管中放入KMnO4固体,右管中放入一小块钠,再向两管均加入适量8mol•L-1的盐酸,半分钟后,盖以橡胶塞并将此支管固定在铁架台上.用一照相机对准此支管,按快门,闪光灯闪亮.请回答:(1)“照像”之前,左管中反应的离子方程式2Mn04-+16H++10Cl-=2Mn2++5Cl2↑+8H20.
(2)“照像”时,灯光闪亮,支管随之出现的现象为支管内气体发生爆炸,胶塞被冲出支管口,化学方程式为Cl2+H2$\frac{\underline{\;光照\;}}{\;}$2HCl.
分析 (1)左管中高锰酸钾与盐酸发生氧化还原反应生成氯化钾、氯化锰、氯气和水;
(2)盐酸易挥发,与Na反应生成氢气,当左侧氯气与右侧氢气混合,光照下反应生成HCl,以此来解答.
解答 解:(1)左管中发生2KMn04+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H20,离子反应为2Mn04-+16H++10Cl-=2Mn2++5Cl2↑+8H20,
故答案为:2Mn04-+16H++10Cl-=2Mn2++5Cl2↑+8H20;
(2)盐酸易挥发,与Na反应生成氢气,当左侧氯气与右侧氢气混合,光照下反应生成HCl,则“照像”时,灯光闪亮,支管随之出现的现象为支管内气体发生爆炸,胶塞被冲出支管口,发生的反应为Cl2+H2$\frac{\underline{\;光照\;}}{\;}$2HCl,
故答案为:支管内气体发生爆炸,胶塞被冲出支管口;Cl2+H2$\frac{\underline{\;光照\;}}{\;}$2HCl.
点评 本题考查实验装置的综合应用,为高频考点,把握反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识及习题信息的应用,题目难度不大.

练习册系列答案
相关题目
10.某学生按如图装置进行实验,下列说法正确的是( )


| A. | A池为原电池,B池为电解质池 | |
| B. | 石墨棒C1为阴极,电极反应式为2H++2e-═H2↑ | |
| C. | 石墨棒C1附近可观察到溶液呈红色 | |
| D. | 当C2极析出224mL气体(标准状况)时,锌电极的质量减少0.65g |
8.下列叙述正确的是( )
| A. | 苯的分子式是C6H6,不能使酸性高锰酸钾溶液褪色,属于饱和烃 | |
| B. | 从苯的凯库勒式看,分子中含有双键,所以属于烯烃 | |
| C. | 乙烯可作果实的催熟剂 | |
| D. | 充分燃烧后产生二氧化碳和水的有机物就是烃 |
15.下列说法正确的是( )
| A. | 氯气、硫酸钡和氨水分别属于非电解质、强电解质和弱电解质 | |
| B. | 体积不同但pH相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的pH仍相同,而m和n无法确定相对大小 | |
| C. | CuCl2+2H2O?Cu(OH)2+2HCl,加入少量硝酸银固体后可以增大CuCl2水解程度 | |
| D. | 用来配制标准NaOH溶液的NaOH固体含有少量的KOH,此时中和测得盐酸的浓度数值一定偏高 |
5.已知氧化性:Br2>Fe3+,在FeBr2溶液中通人Cl2,则所通人Cl2与FeBr2的物质的量之比和所发生的离子方程式对应关系错误的是.( )
| 选项 | n(Cl2)/n(FeBr2) | 离子方程式 |
| A | 1:1 | 2Cl2+2Fe3++2Br-=2Fe3++Br2+4Cl- |
| B | 2:1 | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- |
| C | 1:2 | Cl2+2Br-=Br2+2Cl- |
| D | 2:3 | 4Cl2+62Fe2++2Br-=6Fe3++Br2+8Cl- |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
12.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
| A. | 一定是金属元素 | B. | 可能是稀有气体元素 | ||
| C. | 一定不是非金属元素 | D. | 原子容易失去电子的元素 |
9.在卤代烃RCH2CH2X中化学键如图,则对该卤代烃的下列说法中正确的是( )


| A. | 不能发生水解反应和消去反应 | |
| B. | 能发生水解反应,条件是强碱的醇溶液且加热,被破坏的键是①和④ | |
| C. | 能发生消去反应,条件是强碱的水溶液且加热,被破坏的键是①和② | |
| D. | 发生水解反应时,被破坏的键是①;发生消去反应时,被破坏的键是①和③ |

 ;
; .
.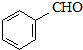 产生.请写出该反应的化学方程式:
产生.请写出该反应的化学方程式: .
. )、丁香油酚(
)、丁香油酚( )在医学上具有广泛用途.
)在医学上具有广泛用途. .
. .
. .请写出以对苯二甲酸(
.请写出以对苯二甲酸(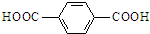 )和乙二醇为原料合成涤纶的化学方程式:
)和乙二醇为原料合成涤纶的化学方程式: