题目内容
16.如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( )
| A. | 只有在t1℃时,NaCl和MgSO4的溶解度才相等 | |
| B. | t1℃~t2℃,MgSO4的溶解度随温度升高而减小 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
分析 根据固体物质的溶解度曲线可以:①某物质在某温度下的溶解度,②判断物质的溶解度随温度变化的变化情况,③比较不同物质在同一温度下的溶解度的大小,④判断通过降温还是升温的方法是晶体析出;注意在同温度下的饱和溶液中溶质的质量分数和溶解度间的关系:$\frac{溶解度}{100+溶解度}$×100%.
解答 解:A、根据两物质的溶解度曲线不难看出,两物质的溶解度曲线有两个交点,即t1℃和t2℃时,两物质的溶解度相等,故A错误;
B、由硫酸镁的溶解度曲线可知,在t1℃~t2℃时,硫酸镁的溶解度随温度的升高而增大,故B错误;
C、在t2℃时,硫酸镁的溶解度处于最大值,所以硫酸镁饱和溶液中溶质的质量分数大,故C正确;
D、由于在t2-t3℃,硫酸镁的溶解度随温度的增大而降低,因此把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液会由饱和溶液变成不饱和溶液,而不会有晶体析出,故D错误;
故选C.
点评 本题难度不大,主要考查了固体溶解度曲线的意义及根据溶解度曲线解决相关的问题,培养学生应用知识解决问题的能力.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
10.向NaCl、NaBr、NaI的混合溶液中通入Cl2后,若溶液中含有Br2,则一定不含有( )
| A. | Cl2 | B. | I- | C. | Br- | D. | Cl- |
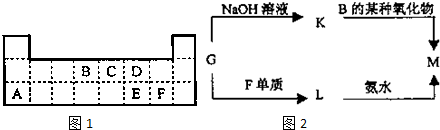
4.如表是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,B元素的原子核内质子数等于中子数.
(1)写出A、B、C三种元素符号:P、O、Cl
(2)B元素位于周期表中第二周期第ⅥA族
(3)C的气态氢化物水溶液显酸性(填“酸”或“碱”)
| B | ||
| A | C |
(2)B元素位于周期表中第二周期第ⅥA族
(3)C的气态氢化物水溶液显酸性(填“酸”或“碱”)
11.1mol NaCl中的Cl-的物质的量为( )
| A. | 0.5 mol | B. | 2 mol | C. | 1 mol | D. | 0.3 mol |
8.溶质质量分数分别为c和5c的硫酸溶液,按等质量混合均匀后,混合溶液中硫酸的质量分数为 ( )
| A. | 3c | B. | 6c | C. | >3c | D. | <3c |
6. 用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
 用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )| A. | 向亚硫酸钠溶液中通入氯气 | B. | 向硝酸银溶液中通入少量氯化氢 | ||
| C. | 向氢碘酸饱和溶液中通入少量氧气 | D. | 向氢氧化钠溶液中通入少量氯气 |

 .
.