题目内容
14.已知碳元素、镁元素和溴等主族元素的原子结构示意图:
则三种元素在周期表的位置依次是( )
| A. | 第二周期ⅣA族 第二周期ⅢA族 第七周期ⅣA族 | |
| B. | 第四周期ⅡA族 第二周期ⅢA族 第七周期ⅣA族 | |
| C. | 第二周期ⅣA族 第三周期ⅡA族 第四周期ⅦA族 | |
| D. | 第二周期ⅣA族 第三周期ⅡA族 第四周期ⅣA族 |
分析 由原子结构可确定主族元素在周期表的位置,电子层数=周期数,最外层电子数=族序数,以此来解答.
解答 解:由C的原子结构中电子层数为2,最外层电子数为4,可知C位于周期表中第二周期ⅣA族,
由Mg的原子结构中电子层数为3,最外层电子数为2,可知Mg位于周期表中第三周期ⅡA族,
由Br的原子结构中电子层数为4,最外层电子数为7,可知Br位于周期表中第四周期ⅦA族,
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握原子结构与元素位置的关系为解答的关键,侧重分析与应用能力的考查,注意电子层、最外层电子数的判断,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
2.下列说法正确的是( )
| A. | 第2周期元素的第一电离能随原子序数递增依次增大 | |
| B. | 氟元素的电负性最大 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | CH2═CH2分子中共有四个σ键和一个π键 |
9.某100ml溶液中含H2SO40.50mol,加入下列物质,溶液导电性增强的是( )
| A. | 0.50 mol Ba(OH)2 | B. | 100 mL水 | C. | 0.50molC2H5OH | D. | 0.50molNa2SO4 |
19.下列依据相关实验得出的结论正确的是( )
| A. | 同温同浓度Na2CO3和Na2SiO3水溶液的pH前者小于后者,则碳的非金属性强于硅 | |
| B. | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后加新制Cu(OH)2悬浊液,加热,无砖红色沉淀,则淀粉没有水解成葡萄糖 | |
| C. | 向无色溶液中加入氯水,再加CCl4,振荡静置后CCl4层呈紫色,则原溶液中含I- | |
| D. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液中一定含有CO32-或HCO3- |
3.下列反应的离子方程式书写正确的是( )
| A. | 制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32-+2H+═CO2↑+H2O | |
| B. | 用惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 饱和Ca(OH)2溶液中加入少量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |



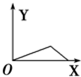
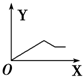
 一定条件下,密闭容器中发生反应:N2(g)+H2(g)?2NH3(g),NH3和H2的物质的量n随时间t变化的关系如图所示.图象中处于平衡状态的点是( )
一定条件下,密闭容器中发生反应:N2(g)+H2(g)?2NH3(g),NH3和H2的物质的量n随时间t变化的关系如图所示.图象中处于平衡状态的点是( )