题目内容
【题目】(一)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下列操作中可能使所测NaOH溶液的浓度数值偏低的是____________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
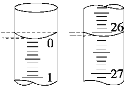
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.50 | |
第二次 | 25.00 | 1.56 | 30.30 | |
第三次 | 25.00 | 0.22 | 26.76 | |
依据上表数据列式计算该NaOH溶液的物质的量浓度______________。
(二)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
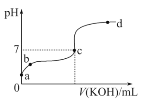
(1)c点溶液中的离子浓度大小顺序为________________。
(2)a、b、c三点中水的电离程度最大的是________。
【答案】D 26.10 c(NaOH)=0.1061 mol·L-1 c(K+)=c(CH3COO-)>c(H+)=c(OH-) c
【解析】
(一)(1)根据c(待测)= 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(2)根据滴定管的结构和精确度以及测量的原理计算;
(3)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出c(NaOH)。
(二)(1)结合c点溶液的成分和酸碱性判断;
(2)酸抑制水的电离程度,可水解的盐促进水的电离。
(一)(1)A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液被稀释,造成V(标准)偏大,根据c(待测)= 分析,测定c(待测)偏大,故A错误;
分析,测定c(待测)偏大,故A错误;
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)= 分析,测定c(待测)无影响,故B错误;
分析,测定c(待测)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= 分析,测定c(待测)偏大,故C错误;
分析,测定c(待测)偏大,故C错误;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)= 分析,测定c(待测)偏小,故D正确;
分析,测定c(待测)偏小,故D正确;
故答案为D;
(2)起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL;
(3)第二次实验误差较大,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=![]() mL=26.52mL,由HCl+NaOH=NaCl+H2O得0.02652L×0.1000 mol/L=0.025L×c(NaOH),解得:c(NaOH)≈0.1061mol/L;
mL=26.52mL,由HCl+NaOH=NaCl+H2O得0.02652L×0.1000 mol/L=0.025L×c(NaOH),解得:c(NaOH)≈0.1061mol/L;
(二)(1)c点pH=7,c(H+)=c(OH-),根据电荷守恒c(H+)+c(CH3COO-)=c(OH-)+c(K+)得c(CH3COO-)=c(K+),则c点溶液中的离子浓度大小顺序为c(CH3COO-)=c(K+)>c(H+)=c(OH-);
(2)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点可看做是CH3COOK和极少量CH3COOH的混合溶液,酸能抑制水的电离,酸的浓度越大,抑制能力越强,所以c点溶液中水的电离程度最大。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案