题目内容
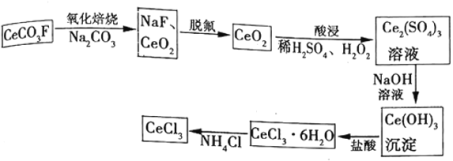
【题目】工业上利用氟碳铈矿(主要成分![]() )提取
)提取![]() 的一种工艺流程如下:
的一种工艺流程如下:
请回答下列问题:
(1)脱氟过程的实验操作是________,酸浸过程中加入![]() 的作用是________。
的作用是________。
(2)常温下,若溶液中的![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() 为________(己知
为________(己知![]() )。
)。
(3)准确称取![]() 样品置于锥形瓶中,加入适量过硫酸铵
样品置于锥形瓶中,加入适量过硫酸铵![]() 溶液将
溶液将![]() 氧化为
氧化为![]() ,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:
,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:![]() )
)
①已知:过二硫化酸的结构式为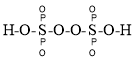 ,其中
,其中![]() 元素的化合价为________。
元素的化合价为________。
②该样品中![]() 的质量分数为________(精确到
的质量分数为________(精确到![]() )。
)。
③若使用久置的![]() 标准溶液进行滴定,测得该
标准溶液进行滴定,测得该![]() 样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
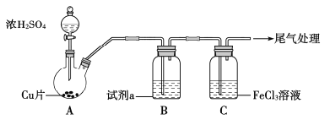
(4)脱氟过程中产生的![]() 因活性弱于熔融的氟氢化钾
因活性弱于熔融的氟氢化钾![]() ,故现代工业以电解熔融的氟氢化钾和氟化氢
,故现代工业以电解熔融的氟氢化钾和氟化氢![]() 混合物制备氟单质,电原理为
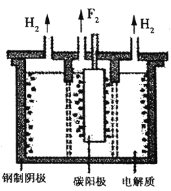
混合物制备氟单质,电原理为![]() 装置如图所示。已知
装置如图所示。已知![]() 是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
【答案】水洗、过滤 作还原剂,将CeO2还原为Ce3+ 9 +6 74.0% 偏大 ![]() 氟气和氢气能发生剧烈反应,引发爆炸
氟气和氢气能发生剧烈反应,引发爆炸
【解析】
根据流程;氟碳铈矿(主要成分CeCO3F)加入碳酸钠焙烧得CeO2、NaF,NaF是钠盐,可溶于水,加水洗涤焙烧的产物并过滤,将氟元素除去,得到滤渣CeO2,再加入稀硫酸和双氧水还原并溶解CeO2,使其转化为Ce2(SO4)3,加入氢氧化钠使Ce3+转化为Ce (OH)3沉淀,再加入盐酸溶解得到CeCl36H2O,加热CeCl36H2O和NH4Cl的固体混合物可得到无水CeCl3,据此分析解答。
(1)根据分析,脱氟过程的实验操作是水洗、过滤;酸浸过程中CeO2转化为Ce2(SO4)3加入双氧水作还原剂,将CeO2还原为Ce3+;
(2)常温下,若溶液中的Ce3+沉淀完全,则Ce3+在溶液中的浓度可看做1×10-5mol/L,![]() ,则c(OH-)=
,则c(OH-)=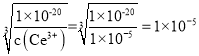 ,pOH=5,此时溶液的pH=14- pOH=14-5=9;
,pOH=5,此时溶液的pH=14- pOH=14-5=9;
(3)①根据过二硫化酸的结构式为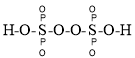 可知,S元素最外层电子全部用于成键,其中
可知,S元素最外层电子全部用于成键,其中![]() 元素的化合价为+6价;
元素的化合价为+6价;
②0.1000mol/L(NH4)2Fe(SO4)2标准消耗体积30.00mL,含有亚铁离子的物质的量为0.1000mol/L×30×10-3L=3×10-3mol,根据反应Fe2++Ce4+═Ce3++Fe3+,利用Ce元素守恒可知,CeCl3的质量为3×10-3mol×246.5g/mol=0.7395g,该样品中![]() 的质量分数为
的质量分数为![]() ×100%≈74.0%。
×100%≈74.0%。
③若使用久置的![]() 标准溶液进行滴定,亚铁离子被氧化为铁离子,滴定时消耗标准液的体积偏大,测得该
标准溶液进行滴定,亚铁离子被氧化为铁离子,滴定时消耗标准液的体积偏大,测得该![]() 样品的质量分数将偏大;
样品的质量分数将偏大;
(4)阴极上得电子,发生还原反应,根据电原理为![]() ,电极反应式为
,电极反应式为![]() 。根据装置图,阴阳两极分别产生氟气和氢气,二者会发生剧烈反应并引发爆炸,故电解制氟时要用镍铜合金隔板将两种气体产物严格分开。
。根据装置图,阴阳两极分别产生氟气和氢气,二者会发生剧烈反应并引发爆炸,故电解制氟时要用镍铜合金隔板将两种气体产物严格分开。

【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
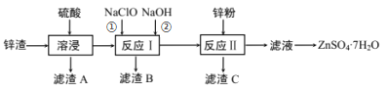
(1)“溶浸”操作中,写出加快“锌渣”“溶浸”速率的两种措施_____________。
(2)“滤渣A”的主要成分是________;“滤渣C”的主要成分是________。
(3)“反应Ⅰ”中①,先加入NaClO反应的离子方程式为____________;“反应Ⅰ”中②,再加入NaOH调节溶液pH约为_________,则滤液中Fe元素浓度小于4×105mol·L-1,而基本存在于“滤渣B”中。(Ksp[Fe(OH)3]=4×1038)
(4)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(5)在实验室中,由滤液获得ZnSO4·7H2O晶体的具体实验操作有_____________。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.ZnSO4 C. Zn3O(SO4)2 D.ZnSO4·H2O
【题目】向200 mL 6 mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题:
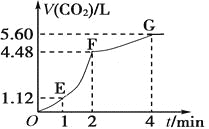
(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则速率从大到小的顺序为____________________________。(用v1、v2、v3表示)
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是_________(填字母)。
A.蒸馏水 |
B.氯化钾固体 |
C.氯化钠溶液 |
D.浓盐酸 |
E.降低温度
F.减少CaCO3
(3)若反应过程中溶液体积的变化忽略不计,计算FG段用盐酸表示的化学反应速率是多少?(写出计算过程):________________。