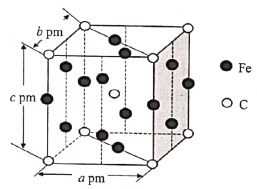
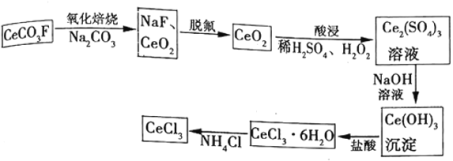
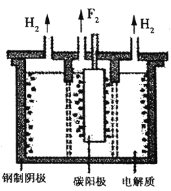
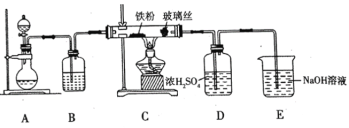
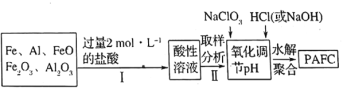
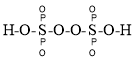题目内容
【题目】某课外活动小组为了测定铜铁合金中铁的质量分数,现取铜铁合金样品20.0 g,将80.0 g稀硫酸平均分成4份,分4次逐渐加入到样品中,每次充分反应后测得剩余固体质量见下表
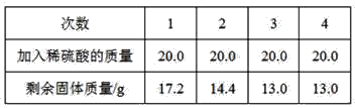
试求:
(1)20.0 g铜铁合金中,铜的质量是______。
(2)铜铁合金中,铁元素的质量分数是______。
(3)20 g稀硫酸溶液中溶质质量是______。
【答案】13 g 35% 4.9 g
【解析】
(1)从表中数据可以看出,加入第4次硫酸时,固体的质量不再改变,说明此时的固体全部是铜,从而得出20.0 g铜铁合金中铜的质量。
(2) 铜铁合金样品20.0 g,求出铜的质量,也就求出了铁的质量,从而铁元素的质量分数。
(3)第一、第二份硫酸,都与铁发生了完全反应,由铁的质量,利用方程式,可求出硫酸的物质的量,从而求出20 g稀硫酸溶液中溶质质量。
(1)由表中数据可知,前两次每20 g稀硫酸最多消耗2.8 g铁,第三次加20 g稀硫酸只消耗了1.4 g铁,说明铁已全部参与反应,硫酸有剩余,剩余的固体全部是铜,其质量为13 g。答案为:13 g;
(2)铁的质量分数为![]() ×100%=35%。答案为:35%;
×100%=35%。答案为:35%;
(3)第一次稀硫酸反应的铁的质量=20 g-17.2 g=2.8 g,
由Fe+H2SO4=FeSO4+H2↑可知,
硫酸的质量=2.8 g÷56 g·mol-1×98 g·mol-1=4.9 g。答案为:4.9 g。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。