题目内容
25℃时,在一定体积pH=12的Ba(OH)2溶液中,逐滴滴加一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后的溶液体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( )
| A、1:9 | B、1:1 |
| C、1:2 | D、1:4 |
考点:pH的简单计算
专题:
分析:氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1反应,设出氢氧化钡、硫酸氢钠溶液的体积,结合溶液的pH和溶液体积换算物质的量列式计算.
解答:
解:pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol,
溶液中的Ba2+恰好完全沉淀时反应的硫酸氢钠物质的量为0.5x×10-2mol,设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:c(OH-)=10-3mol/L,
则:
=10-3,
整理可得:x:y=1:4,
故选D.
溶液中的Ba2+恰好完全沉淀时反应的硫酸氢钠物质的量为0.5x×10-2mol,设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:c(OH-)=10-3mol/L,
则:
| x×10-2-0.5x×10-2 |
| x+y |
整理可得:x:y=1:4,
故选D.
点评:本题考查了酸碱反应的综合计算、溶液pH的计算应用,题目难度中等,明确溶液中氢氧根离子浓度和溶质浓度的关系是解题关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
相关题目
 将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法不正确的是( )
将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法不正确的是( )| A、Mg和Al的总质量为9g |
| B、最初20mLNaOH溶液用于中和过量的稀硫酸 |
| C、NaOH溶液物质的量浓度为5mol?L-1 |
| D、生成的氢气在标准状况下的体积为11.2L |
在强酸性溶液中,下列各组离子能大量共存的是( )
| A、Mg2+、OH-、SO42- |
| B、Ag+、Al3+、Cl- |
| C、Cu2+、Cl-、SO42- |
| D、Fe3+、NH4+、SCN- |
研究人员研制出一种锂水电池,做军事上重要的能源.该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.关于该电池的下列说法不正确的是( )
| A、水既是氧化剂又是溶剂 |
| B、总反应为:2Li+2H2O=2LiOH+H2↑ |
| C、放电时正极上有氢气生成 |
| D、放电时OH-向正极移动 |
 如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细.由此判断下表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细.由此判断下表中所列M、N、P物质,其中可以成立的是( )| M | N | P | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A、A | B、B | C、C | D、D |
下列说法不正确的是( )
| A、麦芽糖及其水解产物均能发生银镜反应 |
| B、用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
D、用甘氨酸(H2N-CH2-COOH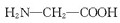 )和丙氨酸( )和丙氨酸(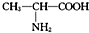 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
把CO2通入下列饱和溶液中,最终一定会有沉淀的是( )
| A、CaCl2 |
| B、Na2CO3 |
| C、Ca(OH)2 |
| D、NaNO3 |
下列说法中,正确的是( )
| A、△H>0表示放热反应,△H<0 表示吸热反应 |
| B、若反应△H>0;△S<0,则反应一定能自发进行 |
| C、1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
| D、热化学方程式中的化学计量数表示物质的量,所以可以是分数 |
