题目内容
11.2SO2(g)+O2(g)$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )| A. | 催化剂 V2O5 不改变该反应的逆反应速率 | |
| B. | 恒压,通入稀有气体,反应速率不变 | |
| C. | 该反应是放热反应,降低温度反应速率变大 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO2 (g)消耗的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
分析 根据催化剂可以同等程度的增大正逆反应的反应速率;增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;并利用降低温度反应速率减小及化学反应速率的计算式来解答.
解答 解:A.催化剂可同等程度的改变正、逆反应的反应速率,故A错误;
B.恒压,通入稀有气体,应增大容器的体积,则浓度减小,反应速率减小,故B错误;
C.降低温度,反应速率减小,故C错误;
D.据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$,故D正确.
故选D.
点评 本题主要考查了影响化学反应速率以及化学平衡的因素,侧重考查学生的分析能力,化学反应速率和化学平衡是化学基本理论的核心知识,既是重点又是难点,也是年年必考的内容,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列四种粒子中,半径按由大到小排列顺序正确的是( )
①基态X的原子结构示意图
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图
④W基态原子有2个能层,电子式为:
①基态X的原子结构示意图

②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图

④W基态原子有2个能层,电子式为:

| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>②>④ | D. | ①>②>④>③ |
2.下列有关元素周期表的说法正确的是( )
| A. | 元素周期表有7个横行,7个周期 | B. | 元素周期表有16个纵行,16个族 | ||
| C. | ⅠA 族的元素全部是金属元素 | D. | 0族元素的原子最外层都有8个电子 |
19.关于化学平衡常数的叙述正确的是( )
| A. | 无论什么情况下,一个化学反应的平衡常数都是一个定值 | |
| B. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 化学平衡常数越大,反应速率越大 |
6.X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n,则下列关系正确的是( )
| A. | a-c=m-n | B. | b+d=m+n | ||
| C. | 元素的金属性:X>Y>Z>R | D. | 离子半径:Z>R>Y>X |
16.下列关系的表述中,正确的是( )
| A. | 分别将CuSO4、Na2CO3、KNO3、Ca(HCO3)2、FeCl3的饱和溶液加热、蒸发、浓缩、冷却后,仍能得到与原物质组成相同的晶体是CuSO4、KNO3 | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等 | |
| D. | 0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
3.等物质的量的N2和CO一定含有相等的( )
①质量 ②体积 ③分子数 ④原子数.
①质量 ②体积 ③分子数 ④原子数.
| A. | ①② | B. | ③④ | C. | ①③④ | D. | ①②③④ |
20.某有机物结构简式如图所示,下列关于该化合物的说法正确的是( )


| A. | 属于芳香族化合物 | |
| B. | 分子式为C27H42 | |
| C. | 核磁共振氢谱证明分子中的5个甲基上的氢原子化学环境相同 | |
| D. | 不能使酸性KMnO4溶液褪色 |
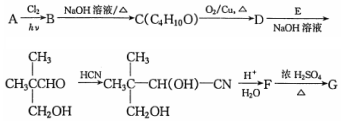
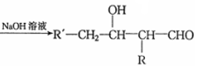
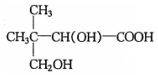 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$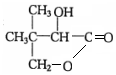 +H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为
+H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为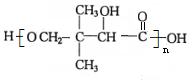 .
.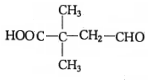 .
.