题目内容
19.下列四种粒子中,半径按由大到小排列顺序正确的是( )①基态X的原子结构示意图

②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图

④W基态原子有2个能层,电子式为:

| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>②>④ | D. | ①>②>④>③ |
分析 X为S原子,Y为Cl原子,Z2-为S2-,W为F原子,电子层数越多,半径越大,同周期随原子序数增大,原子半径减小,同种元素的阴离子的半径大于原子半径;
解答 解:①基态X的原子结构示意图: ,则X为S原子,
,则X为S原子,
②基态Y的价电子排布式:3s23p5,则Y为Cl原子,
③基态Z2-的电子排布图: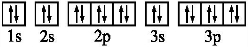 ,Z2-为S2-,
,Z2-为S2-,
④W基态原子有2个能层,结合电子式可知,W为F原子;
电子层数越多,半径越大,F<Cl,同周期随原子序数增大,原子半径减小,则半径:S>Cl,同种元素的阴离子的半径大于原子半径,则半径:S<S2-;
所以半径:S2->S>Cl>F,③①②④
故选C.
点评 本题考查原子半径大小比较,侧重考查分析能力,明确原子半径比较方法是解本题关键,离子半径大小比较也是常考查点,题目难度中等.

练习册系列答案
相关题目
9.下列各组物质的性质或粒子性质的比较正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 还原性:Na+>S2->Br->Cl- | ||
| C. | 热稳定性:PH3>H2S>HCl>HF | D. | 水溶液酸性:HF>HCl>HBr>HI |
10.下列关于化学反应速率的说法中,不正确的是( )
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
7.下列有关油脂的说法正确的是( )
| A. | 油脂是纯净物 | B. | 油脂是高分子化合物 | ||
| C. | 油脂是混合物 | D. | 植物油不能使高锰酸钾溶液褪色 |
14.一定温度下,某一密闭且体积不变的容器内有可逆反应:A(g)+3B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
| A. | A、B、C物质的分子数之比为1:3:2 | |
| B. | 容器内气体的密度不再随时间而改变 | |
| C. | 容器内气体的压强不再随时间而改变 | |
| D. | 单位时间内生成a mol物质A,同时生成3a mol物质B |
4.有4组混合溶液,分别由等体积的0.1mol/L的两种溶液混合而成;
①CH3COOK与HCl;
②CH3COOK与NaOH;
③CH3COOK与KCl;
④CH3COOK与KHCO3,
下列各项排序正确的是( )
①CH3COOK与HCl;
②CH3COOK与NaOH;
③CH3COOK与KCl;
④CH3COOK与KHCO3,
下列各项排序正确的是( )
| A. | pH:②>③>④>① | B. | 溶液中c(H+):①>③>②>④ | ||
| C. | c(CH3COO-):②>④>③>① | D. | c(CH3COOH):①>④>③>② |
10.N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.T1温度时,向密闭容器中通入N2O5气体,部分实验数据见表:下列说法正确的是( )
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内NO2的生成速率为2.96×10-3mol•L-1•s-1 | |
| B. | T1温度下该反应平衡时N2O5的转化率为29.6% | |
| C. | 达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00mol/L | |
| D. | 若温度由T1升至T2时,正逆反应速率都增大,且化学平衡正向移动 |
11.2SO2(g)+O2(g)$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂 V2O5 不改变该反应的逆反应速率 | |
| B. | 恒压,通入稀有气体,反应速率不变 | |
| C. | 该反应是放热反应,降低温度反应速率变大 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO2 (g)消耗的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
 ,其晶体中的化学键类型为离子键、共价键
,其晶体中的化学键类型为离子键、共价键