题目内容
10.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS).下列分析正确的是( )| A. | CuS的溶解度大于PbS的溶解度 | |
| B. | CuS既有氧化性又有还原性 | |
| C. | CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
分析 A.由ZnS或PbS,慢慢转变为铜蓝(CuS)可知,发生沉淀的转化,向Ksp更小的方向进行;
B.由信息可知,只有S元素的化合价升高;
C.ZnS在离子反应中保留化学式;
D.含元素化合价变化的反应为氧化还原反应,相互交换成分无化合价变化的为复分解反应.
解答 解:A.难溶电解质的溶解平衡及沉淀转化是溶解度大的物质向溶解度小的物质转化,PbS能转化为CuS,所以CuS的溶解度小于PbS的溶解度,故A错误;
B.原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,硫元素化合价升高作还原剂具有还原性;铜蓝中硫元素化合价最低,所以能失电子具有还原性,故B错误;
C.CuSO4与ZnS反应的离子方程式是Cu2++ZnS=Zn2++CuS,故C错误;
D.原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,S元素化合价升高,为氧化还原反应;CuSO4与ZnS反应生成硫化铜和硫酸锌是复分解反应,故D正确;
故选D.
点评 本题考查难溶电解质,为高频考点,把握沉淀的转化、离子反应、氧化还原反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
20.100mL 6mol/LH2SO4跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 碳酸钠固体 | B. | 水 | ||
| C. | 硫酸钾固体 | D. | 滴加少量CuSO4溶液 |
5.下列水溶液中的电离方程式书写不正确的是( )
| A. | H2O═H++OH- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHS═Na++HS- | D. | HCO3-═H++CO32- |
15.合成导电高分子材料PPV的反应:
 +nCH2═
+nCH2═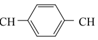 ═CH2$\stackrel{催化剂}{→}$
═CH2$\stackrel{催化剂}{→}$ +(2n-1)HI
+(2n-1)HI
下列说法正确的是( )
 +nCH2═
+nCH2═ ═CH2$\stackrel{催化剂}{→}$
═CH2$\stackrel{催化剂}{→}$ +(2n-1)HI
+(2n-1)HI下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
6.下列燃料燃烧时,产生的气体会造成酸雨的是( )
| A. | 煤 | B. | 液化石油气 | C. | 乙醇 | D. | 水煤气 |
7.
请回答下列问题:
(1)上述四种酸的酸性由强到弱的顺序是H2SO3>CH3COOH>H2CO3>HClO>HCO3-
(2)下列离子方程式正确的是A
A.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3-
B.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O.
| 弱酸 | CH3COOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=3.0×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)上述四种酸的酸性由强到弱的顺序是H2SO3>CH3COOH>H2CO3>HClO>HCO3-
(2)下列离子方程式正确的是A
A.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3-
B.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O.