题目内容
【题目】石棉的化学式可表示为3MgO·2SiO2·2H2O,具有高抗张强度、高挠性耐化学和热浸蚀、电绝缘及具有可纺性的硅酸盐类矿物产品。其中IIA族的元素属于碱土金属。回答下列问题:
(1)与Ca同周期的基态Fe原子的价电子排布式为___________。
(2)BeCl2易升华,液态时以双聚分子存在的BeCl2结构式为___________,其中Be的配位数为___________。
(3)化学式3MgO·2SiO2·2H2O中电负性最大的元素为__________。
SiO2的熔沸点远高于H2O,说明理由:____________________________________________。
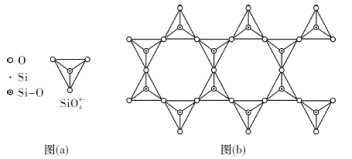
(4)天然硅酸盐组成复杂,阴离子的基本结构单元是SiO44-四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中O与Si的原子数之比为___________,化学式为___________。
(5)经X射线分析鉴定,某一离子晶体属于立方晶系。晶胞顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,写出此晶体的化学式:___________。
【答案】3d54s2  3 O SiO2为原子晶体,H2O为分子晶体 2:5.5 [Si4O11]n6n- BaTiO3
3 O SiO2为原子晶体,H2O为分子晶体 2:5.5 [Si4O11]n6n- BaTiO3
【解析】
(1)与Ca同周期的基态Fe原子的价电子排布式为3d54s2。故答案为:3d54s2;
(2)由BeCl2易升华可知BeCl2的共价性强,其单分子结构为Cl-Be-Cl,(BeCl2)2中Be与Cl之间可形配位键,其双聚分子结构式为 ,Be在双聚分子中,形成三个共价键,可知其配位数为3,故答案为:
,Be在双聚分子中,形成三个共价键,可知其配位数为3,故答案为: ;3;
;3;
(3)化学式3MgO·2SiO2·2H2O中电负性最大的元素为O;SiO2的熔沸点远高于H2O,说明理由:SiO2为原子晶体,H2O为分子晶体。故答案为:O;SiO2为原子晶体,H2O为分子晶体;
(4)n个SiO2通过共用顶角氧离子可形成双链结构,找出重复的结构单元,如图: ,由于是双链,其中顶点氧占
,由于是双链,其中顶点氧占![]() ,Si原子数为4×
,Si原子数为4×![]() +6×
+6×![]() +4+2=11,其中Si与O的原子数之比为2:5.5,化学式为[Si4O11]n6n-。故答案为:2:5.5;[Si4O11]n6n-;
+4+2=11,其中Si与O的原子数之比为2:5.5,化学式为[Si4O11]n6n-。故答案为:2:5.5;[Si4O11]n6n-;
(5)经X射线分析鉴定,某一离子晶体属于立方晶系。晶胞顶点位置为Ti4+所占,8×![]() =1,体心位置为Ba2+所占,所有棱心位置为O2-所占,12×
=1,体心位置为Ba2+所占,所有棱心位置为O2-所占,12×![]() =3,如图
=3,如图 ,此晶体的化学式:BaTiO3。故答案为:BaTiO3。
,此晶体的化学式:BaTiO3。故答案为:BaTiO3。

【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:![]()
![]()
![]() +H2(g)
+H2(g)
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应生成1mol氢气的热效应___(填吸放多少kJ)
(2)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图。
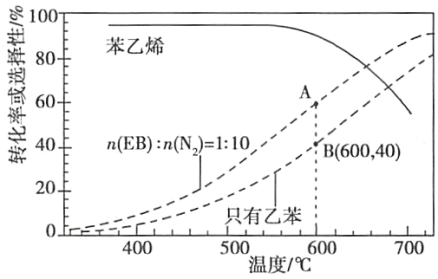
①A、B两点对应的正反应速率较大的是___。
②控制反应温度为600℃的理由是___。
【题目】用如图所示的装置进行实验,仪器![]() 、
、![]() 、
、![]() 中分别盛有试剂1、2、3,其中能达到实验目的是( )
中分别盛有试剂1、2、3,其中能达到实验目的是( )
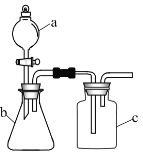
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 |
A | 浓盐酸 |
| 饱和食盐水 | 制备 |
B | 浓硫酸 | 乙醇 | 溴水 | 验证乙烯能使溴水褪色 |
C | 盐酸 |
| 品红试液 | 证明 |
D | 稀硫酸 | 溶液 | 澄清石灰水 | 验证 |
A.AB.BC.CD.D
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
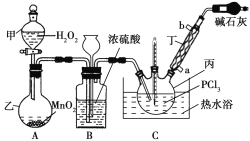
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。