题目内容
16.若以w1和w2分别表示浓度为amol/L和bmol/L氨水的质量分数,且知a=$\frac{b}{2}$,则下列推断正确的是(氨水的密度比纯水的小且浓度越大密度越小)( )| A. | w2>2w1 | B. | 2w2=w1 | C. | 2w1=w2 | D. | w1<w2<2w1 |
分析 利用c=$\frac{1000ρw}{M}$来计算,并利用氨水溶液的浓度越大其密度越小来分析判断.
解答 解:由w1和w2分别表示浓度为amol•L-1和bmol•L-1氨水的质量分数,
则a=$\frac{1000{ρ}_{1}{ω}_{1}}{17}$,b=$\frac{1000{ρ}_{2}{ω}_{2}}{17}$,
且知2a=b,则$\frac{2×1000{ρ}_{1}{w}_{1}}{17}$=$\frac{1000{ρ}_{2}{w}_{2}}{17}$,
即2ρ1w1=ρ2w2,
又氨水溶液的浓度越大其密度越小,则ρ1>ρ2,
即w2>2w1,
故选:A.
点评 本题考查物质的量浓度饿有关计算,明确物质的量与质量分数的关系及氨水溶液中浓度与密度的关系是解答本题的关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
6.实验室欲配制1.00mol/L的NaCl溶液80mL.下列说法正确的是( )
| A. | 选用100mL容量瓶,并用蒸馏水洗净后烘干 | |
| B. | 称取5.9g NaCl固体倒入容量瓶中溶解 | |
| C. | 定容时俯视刻度会导致浓度偏高 | |
| D. | 摇匀、静置后发现凹液面低于刻度线1~2mm,用胶体滴管加水至与刻度线相平即可 |
7.下列判断合理的是( )
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③碱性氧化物一定是金属氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥稀释浓H2SO4时,将水慢慢倒入浓H2SO4中,并不断搅拌.
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③碱性氧化物一定是金属氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥稀释浓H2SO4时,将水慢慢倒入浓H2SO4中,并不断搅拌.
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②③⑤ |
11.同温同压下,等质量的下列气体所占有的体积最大的是( )
| A. | O2 | B. | N2 | C. | CO2 | D. | SO2 |
2. 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品.
(一)制备α-氯乙基苯的反应如下:
 +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
(1)若初始投入乙苯为2mol,恒压容器容积10L,用氯气表示该反应0-5分钟内的速率υ(Cl2)=0.32mol•L-1•mim-1.T℃时,计算该反应的化学平衡常数K=16.6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为升高温度.
(2)图中能正确反映平衡常数K随温度变化关系的曲线为b(填曲线标记字母),其判断理由是该反应正方向放热,升高温度使平衡正向移动,平衡常数增大.
(二)催化脱氢生产苯乙烯的反应如下:
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol
(3)气相反应的化学平衡常数有多种表示方法,可用各气体物质的量分数代替浓度项表示平衡常数,写出上述反应的平衡常数表达式Kχ=$\frac{λ(氢气)•λ(苯乙烯)}{λ(乙苯)}$.(用符号χ表示气体物质的量分数).
(4)工业上,在恒压条件下进行上述反应时,将乙苯与水蒸气的混合气体通入反应器中(已知水蒸气不参与反应),加入水蒸气可以使乙苯的转化率增大,用化学平衡理论解释乙苯转化率增加的原因恒压条件下加入水蒸气,体积增大,使反应体系减压,平衡正向移动.
 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品.(一)制备α-氯乙基苯的反应如下:
 +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
(2)图中能正确反映平衡常数K随温度变化关系的曲线为b(填曲线标记字母),其判断理由是该反应正方向放热,升高温度使平衡正向移动,平衡常数增大.
(二)催化脱氢生产苯乙烯的反应如下:
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol(3)气相反应的化学平衡常数有多种表示方法,可用各气体物质的量分数代替浓度项表示平衡常数,写出上述反应的平衡常数表达式Kχ=$\frac{λ(氢气)•λ(苯乙烯)}{λ(乙苯)}$.(用符号χ表示气体物质的量分数).
(4)工业上,在恒压条件下进行上述反应时,将乙苯与水蒸气的混合气体通入反应器中(已知水蒸气不参与反应),加入水蒸气可以使乙苯的转化率增大,用化学平衡理论解释乙苯转化率增加的原因恒压条件下加入水蒸气,体积增大,使反应体系减压,平衡正向移动.
9.下列有关硅的叙述中,正确的是( )
| A. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| B. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| C. | SiO2是酸性氧化物,能与水反应生成硅酸 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
6.一定温度下,能说明反应 A(g)+2B(g)?3C(g)已达到平衡状态的是( )
| A. | C 的生成速率与 C 的分解速率相等 | |
| B. | 单位时间内消耗 amolA,同时生成 3amolC | |
| C. | 容器内压强不再变化 | |
| D. | 混合气体的物质的量不再变化 |
7.室温时,0.1mol/L某一元酸HA的水溶液PH=4.下列描述不正确的是( )
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |

 →
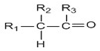
→
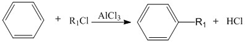
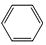 +R1Cl$\stackrel{AlCl_{3}}{→}$
+R1Cl$\stackrel{AlCl_{3}}{→}$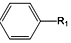 +HCl
+HCl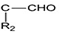 +H2O(R1、R2、R3代表烃基或氢原子)回答下列问题:
+H2O(R1、R2、R3代表烃基或氢原子)回答下列问题: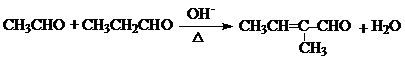 .
.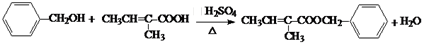 .
.