题目内容
2.实验室现有两种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4;酚酞:8.2~10.0.用0.1000mol/L的稀硫酸滴定未知浓度的NaHCO3溶液,当反应恰好完全时,下列叙述正确的是( )| A. | 可选用酚酞作指示剂,溶液由红色变为无色 | |
| B. | 可选用酚酞作指示剂,溶液由无色变为红色 | |
| C. | 可选用甲基橙作指示剂,溶液由黄色变为橙色 | |
| D. | 可选用甲基橙作指示剂,溶液由橙色变为红色 |
分析 先根据盐类的水解考虑溶液的酸碱性,再根据指示剂的变色范围与酸碱中和后的越接近越好,且变色明显(终点变为红色),溶液颜色的变化由浅到深容易观察,而由深变浅则不易观察,碳酸氢钠为强碱弱酸盐,溶液呈碱性,与酸反应生成二氧化碳溶于水,其溶液略呈酸性,据此分析解答.
解答 解:碳酸氢钠电离出的碳酸氢根离子部分水解生成碳酸和氢氧根离子,其水解的离子方程式为:HCO3-+H2O?H2CO3+OH-,碳酸氢钠溶液呈碱性,酚酞的变色范围是8-10,酚酞为指示剂,所以滴有酚酞的碳酸氢钠溶液呈浅红色,滴定发生反应生成硫酸钠、水、二氧化碳,离子反应为H++HCO3-═H2O+CO2↑,溶液呈中性,但二氧化碳溶于水,溶液呈酸性,应选择酸性范围内变色的指示剂,故AB错误;
甲基橙变色范围pH=3.1~4.4,所以滴有甲基橙的碳酸氢钠溶液呈黄色,滴定发生反应生成硫酸钠、水、二氧化碳,离子反应为H++HCO3-═H2O+CO2↑,溶液呈中性,但二氧化碳溶于水,溶液呈酸性,所以终点时溶液呈橙色,所以滴定过程中溶液由黄色变为橙色,溶液颜色的变化由浅到深容易观察,故C正确,D错误;
故选C.
点评 本题考查滴定指示剂的选择,掌握碳酸氢钠的性质以及和硫酸酸之间的滴定反应产物的性质是解答关键,注意知识的灵活应用,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
7.某二价阳离子,有54个电子,其质量数是137,则该原子核内的中子数为( )
| A. | 83 | B. | 81 | C. | 85 | D. | 56 |
11.与氖(Ne)原子电子排布相同的两种离子组成的化合物是( )
| A. | Na2S | B. | KCl | C. | MgCl2 | D. | NaF |
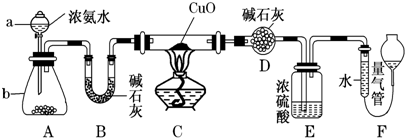
 ,A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O

 DBrCH2CH2Br
DBrCH2CH2Br .
. ,该主要成分完全燃烧的化学方程式CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
,该主要成分完全燃烧的化学方程式CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.