题目内容
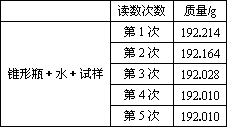
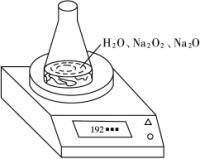
某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g,锥形瓶和水的质量为190.720 g),利用下图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如下表所示.

(1)写出Na2O2和H2O反应的化学方程式:_____________.
(2)计算过氧化钠质量分数时,必需的数据是________,不必做第6次读数的原因是________.
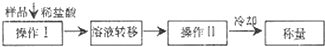
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
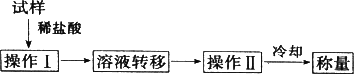
①操作Ⅱ的名称是________.
②需直接测定的物理量是________.
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要________、________(固定、夹持仪器除外).
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果________(填“偏大”、“偏小”或“不变”).
解析:
|
答案:(1)2Na2O2+2H2O=4NaOH+O2↑. (2)试样质量、锥形瓶和水的质量、第4(或5)次读数(或用具体数值表示);锥形瓶内质量已达恒重. (3)①蒸发.②NaCl的质量.③烧杯;玻璃棒.④偏大. 解析:(2)由反应2Na2O2+2H2O=4NaOH+O2↑和Na2O+H2O=2NaOH可知,只要知道试样质量、锥形瓶和水的质量,就可利用充分反应前后的质量差求得Na2O2的质量分数.由于第4次称量以后的读数皆为192.010 g,说明锥形瓶内物质质量已达恒重,故不必做第6次称量. (3)由本方案的操作流程可知,操作Ⅰ是溶解,在将试样溶于盐酸的过程中,所用仪器有烧杯、玻璃棒,在将所得溶液转移至蒸发皿的过程中,用到仪器除烧杯、玻璃棒外还有蒸发皿,显然操作Ⅱ的名称为蒸发,还需要用到的仪器有烧杯和玻璃棒. 设试样的质量为m1,其中Na2O2和Na2O的物质的量分别为x、y,充分反应后所得NaCl的质量为m2,则:
显然溶液转移不完全时,m2减小,则Na2O2的物质的量增大而m1不变,则Na2O2质量分数的测定结果偏大. 评注:第一个实验方案是测数据求出放出氧气的量,由2Na2O2~O2求算Na2O2的量、Na2O2的质量分数.第二个实验方案是依据所得NaCl的质量数据,通过钠守恒和质量守恒列方程组求出Na2O2的质量分数.明确了上述原理就不难回答有关问题了. |

 阅读快车系列答案
阅读快车系列答案
| 读数次数 | 质量(g) |
锥形瓶+水+试样 | 第一次 | 192.214 |
第二次 | 192.164 | |
第三次 | 192.028 | |
第四次 | 192.010 | |
第五次 | 192.010 |
(1)写出Na2O2和H2O反应的化学方程式 。
(2)计算过氧化钠的质量分数时,必需的数据是 ,不必作第六次读数的原因是 。
(3)测定上述样品(
![]()
①操作Ⅱ的名称是 。
②需直接测定的物理量是 。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2的质量分数的测定结果 (填“偏大”“偏小”或“不变”)。
| 读数次数 | 质量/g |
锥形瓶+水+试样 | 第1次 | 192.214 |
第2次 | 192.164 | |
第3次 | 192.028 | |
第4次 | 192.010 | |
第5次 | 192.010 |
(1)写出Na2O2和H2O反应的化学方程式________________________________。
(2)计算过氧化钠质量分数时,必需的数据是________________。不必作第6次读数的原因是________________________________。
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
样品↓稀盐酸
![]()
①操作Ⅱ的名称是____________。
②需直接测定的物理量是____________。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要________、________(固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果____________(填“偏大”“偏小”或“不变”)。
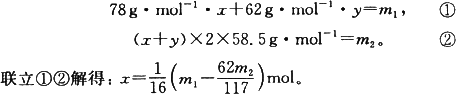
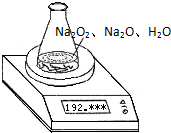 某种含有少量氧化钠的过氧化钠试样质量为1.56g,为测定各成分的质量分数,按如图所示,原锥形瓶和水的总质量为190.72,将1.56g上述样品投入锥形瓶中,充分反应后,电子天平最终的读数为192.12g.
某种含有少量氧化钠的过氧化钠试样质量为1.56g,为测定各成分的质量分数,按如图所示,原锥形瓶和水的总质量为190.72,将1.56g上述样品投入锥形瓶中,充分反应后,电子天平最终的读数为192.12g. (2004?上海)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(2004?上海)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表: