题目内容
12.配平下列反应方程式①4Zn+10HNO3(极稀)→4Zn(NO3)2+1N2O↑+5H2O
②该反应的还原剂为Zn,还原产物为N2O.(写化学式)
③若产生的N2O在标准状况下体积为2.24L,则反应中转移了0.8mol电子.被还原的HNO3为0.2 mol.
分析 反应中锌元素化合价从0价升高到+2价,被氧化,为还原剂,对应氧化产物;硝酸中+5价的N,化合价降为氧化氮中+1价的氮,硝酸为氧化剂,对应还原产物,依据氧化还原反应中得失电子守恒规律、原子个数守恒规律配平方程式,依据方程式进行有关氧化还原反应的计算.
解答 解:反应中锌元素化合价从0价升高到+2价,被氧化,Zn为还原剂,对应氧化产物;硝酸中+5价的N,化合价降为氧化氮中+1价的氮,硝酸为氧化剂,对应N2O为还原产物,要使氧化剂得到电子数等于还原剂失去电子数,则锌的系数为1,氧化氮系数为1,依据原子个数守恒规律,反应方程式:4Zn+10HNO3(极稀)→8Zn(NO3)2+1N2O↑+5H2O,生成1molN2O转移8mol电子,被还原的硝酸的物质的量为2mol,则若产生的N2O在标准状况下体积为2.24L,物质的量为0.1mol,则转移电子数为0.8mol,被还原的HNO3为0.2mol,
故答案为:①4;10;4;1;5;
②Zn;N2O;
③0.8;0.2;
点评 本题考查了氧化还原反应方程式配平及有关计算,明确氧化还原反应基本概念及得失电子守恒规律是解题关键,题目难度不大.

练习册系列答案
相关题目
20.下列离子方程式正确的是( )
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
4.在4FeO42-+20H+═4Fe3++3O2↑+10□反应中,下列说法正确的是( )
| A. | FeO42- 只做氧化剂 | |
| B. | O2是还原产物 | |
| C. | □处对应的物质是H2O | |
| D. | 若10 mol H+参加反应,转移的电子的物质的量是10 mol |
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 200mL 1mol•L-1Fe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA | |
| B. | 室温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 室温下,1L pH=12的Ba(OH)2溶液中OH-数目为0.2NA | |
| D. | 室温下,1L pH=1的盐酸中,由水电离的H+数目为10-13NA |
 ,B
,B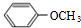 ,C
,C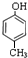 .
.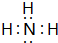 .实验室制取该种物质的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O.
.实验室制取该种物质的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O.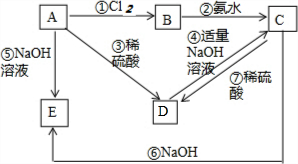 已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)
已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)