题目内容
某弱酸溶液中存在电离平衡HA?H++A-,下列叙述不正确的是( )
分析:A.根据电荷守恒判断;
B.加水稀释促进弱电解质电离,氢离子浓度减小,根据水的离子积常数确定氢氧根离子浓度的变化;
C.加入含有相同离子的物质抑制弱电解质的电离;
D.电离平衡常数只与温度有关.
B.加水稀释促进弱电解质电离,氢离子浓度减小,根据水的离子积常数确定氢氧根离子浓度的变化;
C.加入含有相同离子的物质抑制弱电解质的电离;
D.电离平衡常数只与温度有关.
解答:解:A.溶液呈电中性,阴阳离子所带电荷相等,根据电荷守恒得:c(H+)=c(OH-)+c(A-),故A正确;
B.加水稀释促进弱电解质电离,氢离子浓度减小,水的离子积常数不变,所以c(OH-)增大,故B正确;
C.加入NaA时,c(A-)增大,从而抑制弱酸电离,故C正确;
D.温度不变,弱酸的电离平衡常数不变,故D错误;
故选D.
B.加水稀释促进弱电解质电离,氢离子浓度减小,水的离子积常数不变,所以c(OH-)增大,故B正确;
C.加入NaA时,c(A-)增大,从而抑制弱酸电离,故C正确;
D.温度不变,弱酸的电离平衡常数不变,故D错误;
故选D.
点评:本题考查了弱电解质的电离,注意电离平衡常数只与温度有关,与溶液的浓度无关,为易错点.

练习册系列答案
相关题目
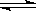 CH3COO-+H+,加水一定能使电离平衡右移,氢氧根离子浓度增大
CH3COO-+H+,加水一定能使电离平衡右移,氢氧根离子浓度增大