题目内容
【题目】以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
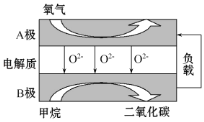
(1)B极电极反应式为______________________。
(2)若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的质量为__________g;若外电路只通过了0.06mol电子,且阴极产生气体在标准状况下的体积为224mL,要使原溶液复原,可向电解后的溶液中加入____________。
A.CuO1.60g H2O 0.18g B.Cu(OH)2 1.96g
C.Cu2(OH)2CO3 2.22g D.CuCO3 2.48g
(3)目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:
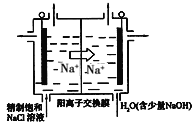
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的_____(填“左”或“右”)边电极;写出阳极产生ClO2的电极反应式_________________________________。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的数目为__________。
【答案】.CH4-8e-+4O2-=CO2+2H2O 4 AC 右 Cl--5e-+2H2O=ClO2+4H+ 0.01NA
【解析】
(1)B极上是甲烷发生氧化反应,生成二氧化碳,由此书写电极反应式;
(2)电解时阳极是水电离出的氢氧根离子放电,生成氧气,由此书写电极反应式;根据整个电路转移电子的物质的量相等分析解答;电解质复原:出什么加什么,据此回答;
(3)①根据钠离子的移动方向可知a极为电解池的阳极,与电源的正极相连接,故接右边,在阳极为氯离子放电,且生成物为ClO2,由此书写电极反应式;
②H+在阴极上放电产生氢气,转移电子的物质的量n(e-)=2n(H2)=2×0.112L÷22.4L/mol=0.01mol,则在内电路中移动的电荷为0.01mol,由此分析解答。
(1)由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极方程式为.CH4-8e-+4O2-=CO2+2H2O
故答案为:.CH4-8e-+4O2-=CO2+2H2O
(2)用惰性电解硫酸铜溶液时,阳极为水电离的OH-放电,电极反应式为:2H2O-4e-=4H++O2↑,当阳极产生11.2L气体时,转移的电子为11.2L÷22.4L/mol×4=2mol,由电子守恒可得甲醇的质量为2mol÷8××16g/mol=4g,在电解硫酸铜溶液的过程中,阴极析出铜,阳极析出氧气,若要使溶液复原,根据原子守恒可知应向溶液中加入CuO或CuCO3,根据计算可知答案;故答案为:4;AC;
(3)①根据钠离子的移动方向可知左边为电解池的阳极,与电源的正极相连接,故接右边,在阳极为氯离子放电,且生成物为ClO2,则电极反应为:Cl--5e-+2H2O=ClO2+4H+ ,故答案为:右边;Cl--5e-+2H2O=ClO2+4H+ ;
②H+在阴极上放电产生氢气,转移电子的物质的量n(e-)=2n(H2)=2×0.112L/22.4L/mol
=0.01mol,则在内电路中移动的电荷为0.01mol,通过阳离子交换膜的阳离子的数目为0.01NA,故答案为:0.01NA

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1