题目内容
6.某合作学习小组讨论辨析以下说法中正确的是⑥⑦⑧①硅是光导纤维的主要成分
②CO2气体通入CaCl2溶液中会出现混浊
③冰和干冰既是纯净物又是化合物
④某气体能使品红溶液褪色,该气体是SO2
⑤盐酸和食醋既是化合物又是酸
⑥鉴别MgCl2、AlCl3、FeCl3溶液可用NaOH试剂
⑦豆浆、雾都是胶体
⑧利用丁达尔效应可以区分溶液和胶体.
分析 ①光导纤维的主要成分是二氧化锆晶体,所以SiO2可以制光导纤维;
②CO2与CaCl2不反应,据此进行判断;
③冰是水,干冰是二氧化碳,都是由一种物质组成的,并且都是由不同种元素组成的纯净物;
④Cl2、Na2O2、H2O2等氧化性;SO2与品红发生化合反应褪色;
⑤盐酸是氯化氢的水溶液;
⑥MgCl2、AlCl3、FeCl3溶液,阴离子相同,阳离子不同,分别与NaOH反应的现象为:白色沉淀、生成白色沉淀后溶解、红褐色沉淀;
⑦豆浆是固溶胶、雾是气溶胶;
⑧利用丁达尔效应可以区分溶液和胶体.
解答 解:①光导纤维的主要成分是二氧化锆晶体,所以SiO2可以制光导纤维,故错误;
②CO2与CaCl2不反应,所以不会出现浑浊,故错误;
③冰是水,干冰是二氧化碳,它们在一起是属于混合物,故错误;
④Cl2、Na2O2、H2O2等氧化性;SO2与品红发生化合反应褪色,所以不一定是二氧化硫,故错误;
⑤盐酸是氯化氢的水溶液,是混合物,故错误;
⑥MgCl2、AlCl3、FeCl3溶液,阴离子相同,阳离子不同,分别与NaOH反应的现象为:白色沉淀、生成白色沉淀后溶解、红褐色沉淀,所以现象不同,故正确;
⑦豆浆是固溶胶、雾是气溶胶,都是胶体,故正确;
⑧利用丁达尔效应可以区分溶液和胶体,故正确;
故答案为:⑥⑦⑧.
点评 本题考查了常见物质的组成、性质和应用,熟悉物质的组成是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列离子在溶液中能大量共存的是( )
| A. | Al3+、K+、Cl-、AlO2- | B. | Al3+、Na+、NO3-、HCO3- | ||
| C. | NH4+、Fe2+、SO42-、NO3- | D. | Ca2+、H+、NO3-、S2O32- |
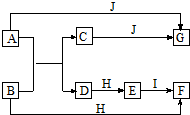
14.如图是产生和收集气体的实验装置,该装置最适合于( )


| A. | 用浓盐酸和MnO2反应制取Cl2 | |
| B. | 用浓硫酸与Na2SO3反应制取SO2 | |
| C. | 用H2O2溶液和MnO2反应制取O2 | |
| D. | 用NH4Cl浓溶液和Ca(OH)2浓溶液反应制取NH3 |
1.设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,22.4L乙醇的分子数为NA | |
| B. | 1mol甲基中含有的电子数为10NA | |
| C. | 13g乙炔和苯的混合气体中含有原子总数为2NA | |
| D. | 1L 0.1mol•L-1乙酸溶液中H+数目为0.1NA |
11.下列关于氧化钠和过氧化钠的叙述正确的是( )
| A. | 将Na2O与Na2O2分别加入滴有酚酞的水中,二者现象相同 | |
| B. | 在Na2O2与水的反应中,氧化产物与还原产物物质的量之比为1:4 | |
| C. | 相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1 | |
| D. | 等质量的Na2O与Na2O2投入等量且足量水中充分反应后所得溶液物质的量浓度相等 |
6.电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HC1和CH3COOH溶液滴定曲线示意图.下列有关判断正确的是( )

| A. | 曲线①代表0.1 mol/L KOH溶液滴定HC1溶液的滴定曲线,曲线②代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)等于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
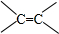 $\frac{\underline{\;[O]\;}}{\;}$
$\frac{\underline{\;[O]\;}}{\;}$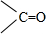 +
+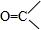
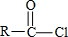 +H2O→
+H2O→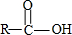 +HCl
+HCl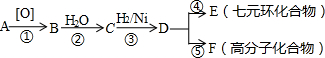
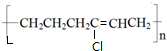 、BOHCCH2CH2CH2CH2COCl、EOHCCH2CH2CH2CH2COOH
、BOHCCH2CH2CH2CH2COCl、EOHCCH2CH2CH2CH2COOH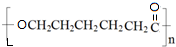 +nH2O,缩聚反应.
+nH2O,缩聚反应.