题目内容
20.如图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素.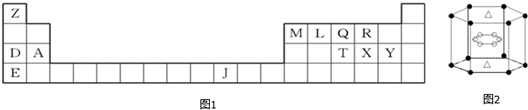
(1)T、X、Y原子的第一电离能由小到大的顺序是S<P<Cl(用元素符号表示).
(2)LX2分子的电子式是
 ,XY2分子是极性分子(填“极性分子”或“非极性分子”);QY3分子中Q采用sp3杂化.
,XY2分子是极性分子(填“极性分子”或“非极性分子”);QY3分子中Q采用sp3杂化.(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式J(LR)4,其中J的化合价是0价.则基态J原子的核外电子排布式是1s22s22p63s23p63d84s2;写出与配位体微粒互为等电子体的离子、分子各一种CN-、N2.
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有4种同分异构体(其中Q以三个单键与其他原子相连),请写出其中沸点最低的物质的结构简式N(CH3)3.
(5)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高纪录.如图2所示的是该化合物的晶体结构单元.图中上下底面中心“△”处的原子是Mg(填元素符号).
分析 根据元素在周期表中的位置知,从A为Mg、D为Na,E为K,L为C,M为B,Q为N,R为O,T为P,X为S,Y为Cl,
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族大于第ⅥA族元素第一电离能;
(2)LX2分子为二硫化碳,电子式与二氧化碳类似,XY2分子为二氯化硫,根据价层电子对互斥理论计算价层电子对数和杂化轨道类型,根据空间结构确定分子的极性;
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式J(LR)4,其中J的化合价是0价,则J为28号元素Ni,配位体为CO,具有相同原子个数、价电子数的互为等电子体;
(4)根据该有机物中C、N、H原子之间都是以单键相连,以氮原子为中心,氮原子连接三个甲基;氮原子连一个氢原子、一个甲基和一个乙基;氮原子连两个氢原子和一个正丙基;氮原子连两个氢原子和一个异丙基;支链越多,沸点越低;
(5)由元素在周期表中位置,可知A为Mg,M为B,根据均摊法计算晶胞中Mg、B原子数目,确定面心原子.
解答 解:根据元素在周期表中的位置知,从A为Mg、D为Na,E为K,L为C,M为B,Q为N,R为O,T为P,X为S,Y为Cl,
(1)T、X、Y分别为P、S、Cl,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族大于第ⅥA族元素第一电离能,故大小顺序为S<P<Cl,故答案为:S<P<Cl;
(2)LX2分子为二硫化碳,电子式与二氧化碳类似,为 ,XY2分子为二氯化硫,中心原子有2对孤对电子,2对成键电子,空间构型为V形,为极性分子,NCl3分子为中N原子有4对价层电子对,故杂化类型为sp3,
,XY2分子为二氯化硫,中心原子有2对孤对电子,2对成键电子,空间构型为V形,为极性分子,NCl3分子为中N原子有4对价层电子对,故杂化类型为sp3,
故答案为: ;极性分子;sp3;
;极性分子;sp3;
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式J(LR)4,其中J的化合价是0价,则J为Ni,基态原子的核外电子排布式是1s22s22p63s23p63d84s2,配位体为CO,具有相同原子个数、价电子数的等电子体为CN-、N2,
故答案为:1s22s22p63s23p63d84s2;CN-、N2;
(4)从该化合物的分子组成上可以看出,该有机物中C、N、H原子之间都是以单键相连,以氮原子为中心,氮原子连接三个甲基时是一种同分异构体,氮原子连一个氢原子、一个甲基和一个乙基时是另一种同分异构体,氮原子连两个氢原子和一个正丙基时是第三种同分异构体,氮原子连两个氢原子和一个异丙基时是第四种同分异构体,共有4种同分异构体;支链越多,沸点越低,故沸点最低的结构简式为N(CH3)3,
故答案为:4;N(CH3)3;
(5)由元素在周期表中位置知A为Mg,M为B,A和M组成的一种化合物MgB2,面心原子数目为2×$\frac{1}{2}$=1,顶点原子数目为12×$\frac{1}{6}$=2,面心原子为Mg,
故答案为:Mg.
点评 本题考查元素周期表、元素周期律、晶胞计算等,注意对元素周期表的整体把握,掌握元素周期律,侧重考查基本理论,熟悉价层电子对互斥理论、元素周期律即可解答,注意第一电离能中的异常现象,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | O | B. | K | C. | B | D. | Be |
| A. | CH3CH2OH→CH2=CH2↑+H2O | B. |  +Br2→ +Br2→ +HBr +HBr | ||
| C. | CH3CHO+H2→CH3CH2OH | D. | CH4+2O2→CO2+2H2O |
①苯 ②苯酚 ③亚硫酸 ④NaOH溶液 ⑤AgNO3溶液 ⑥裂解汽油 ⑦己烷 ⑧镁粉.
| A. | ①⑦ | B. | ①③⑥ | C. | ①⑥⑦⑧ | D. | ①②⑤⑦ |
| A. | 水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 苛性钠溶液 | D. | 四氯化碳溶液 |
| A. | 通入足量SO2的溶液中:Fe2+、Na+、SO42-、ClO- | |
| B. | 常温下,c(H+)═$\sqrt{{K}_{w}}$的溶液中:Na+、Fe3+、HCO3-、K+ | |
| C. | 水电离出的c(OH-)=10-13 mol/L的溶液中:Ba2+、Cl-、NO3-、I- | |
| D. | 遇酚酞显红色的溶液中:AlO2-、HCO3-、K+、NH4+ |
| A. | 在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2,离子反应方程式为Mn2++ClO-+H2O=MnO2↓+Cl-+2H+ | |
| B. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| C. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3-能大量共存 | |
| D. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+=H2O+BaCO3↓ |