题目内容
14.下列微粒:H+、Cu2+、Ag+、Fe3+、Cl-、S2-、I-、MnO4-、ClO3-、NO3-、SO32-、S、Cl2、Na;其中只有氧化性的是H+、Cu2+、Ag+、Fe3+、MnO4-、NO3-;
只有还原性的是Cl-、S2-、I-、Na;
既有氧化性又有还原性的是SO32-、S、Cl2、ClO3-.
分析 只有氧化性的物质元素的化合价处于最高价态,只有还原性的物质元素处于最低价态,当元素的化合价处于中间价态时,既具有氧化性又具有还原性,据此分析.
解答 解:H+、Cu2+、Ag+、Fe3+、MnO4-、NO3-中元素化合价均处于最高价态,只具有氧化性,
Cl-、S2-、I-、Na中元素的化合价均处于最低价态,只具有还原性,
SO32-、S、Cl2中元素的化合价处于中间价态,既具有氧化性又具有还原性,ClO3-中元素的化合价既又最高价又有最低价,所以既具有氧化性又具有还原性;
故答案为:H+、Cu2+、Ag+、MnO4-、NO3-、Fe3+;Cl-、S2-、I-、Na;SO32-、S、Cl2、ClO3-.
点评 本题考查氧化还原反应,题目难度不大,注意元素的化合价与物质的性质的关系,把握氧化还原反应的规律,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
4.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )


| A. | 化学反应中能量变化的主要原因是物质状态的改变 | |
| B. | 铝热反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为吸热反应 |
5.氢能开发的首要问题是研究如何以水为原料获取氢气,下列研究方向可行的是( )
| A. | 电解水产生氢气 | |
| B. | 开发特殊物质作催化剂,降低水分解过程中所需要的能量 | |
| C. | 大量建设水电站,用电力分解水制取氢气 | |
| D. | 寻找更多化石燃料,利用燃烧放热,使水分解产生氢气 |
2.用过量的锌与稀硫酸反应制H2时,下列能减缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量Na2CO3固体 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量NaOH固体 | D. | 加水 |
9.化学与生产、生活息息相关,下列有关说法错误的是( )
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 从海水中提取氯化钠、溴、碘不一定都要通过化学反应才能实现 | |
| C. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| D. | 用高纯度的硅来制备光导纤维 |
19.下列实验,能达到目的是( )
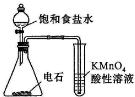

| A. | 用图装置检验乙炔的还原性 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液,鉴别己烯中是否混有少量甲苯 | |
| C. | 用裂化汽油从溴水中提取溴 | |
| D. | 将混合气体通过酸性高锰酸钾溶液,除去甲烷中混有的乙烯 |
6.下列一组反应的反应类型相同的是( )
| A. | 由溴乙烷制乙醇;由乙烯与水反应制乙醇 | |
| B. | 乙烯使溴的四氯化碳褪色,甲苯使KMnO4酸性溶液褪色 | |
| C. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯; 苯与液溴在催化剂存下制取溴苯 | |
| D. | 1-氯丙烷与NaOH的乙醇溶液加热反应;l-氯丙烷与NaOH的水溶液加热反应 |
3.用导线将Fe和Cu连接置于同一稀硫酸溶液中,下列叙述正确的是( )
| A. | 正极附近c(H+)逐渐增大 | |
| B. | SO42-向正极移动 | |
| C. | 正、负极附近c(H+)基本不变 | |
| D. | Fe片、Cu片同时冒出气泡,则说明Zn片不纯 |
18.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解.某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用图I装置制取氨气,可选择的试剂是氯化铵与氢氧化钙.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
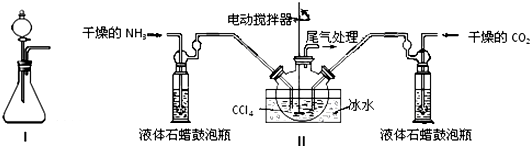
注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是防止反应放热使产物分解,提高反应物转化率,液体石蜡鼓泡瓶的作用是观察气泡调节NH3和CO2通入比例,控制反应速率.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
②根据①的结论:取氨基甲酸铵样品3.95g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97g.则样品中氨基甲酸铵的物质的量分数为80%.[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
(1)如用图I装置制取氨气,可选择的试剂是氯化铵与氢氧化钙.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.

注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是防止反应放热使产物分解,提高反应物转化率,液体石蜡鼓泡瓶的作用是观察气泡调节NH3和CO2通入比例,控制反应速率.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入:_______. | _______,证明固体中含有碳酸氢铵. |