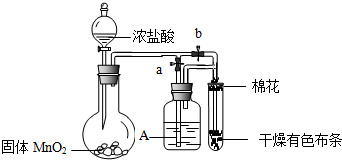
题目内容
18.实验室加热氯酸钾(KClO3)和二氧化锰(作催化剂)的混合物制取氧气.若完全反应收集到标准状况下3.36L氧气,至少需要多少克氯酸钾?剩余的固体混合物加入100g水溶解、过滤、得滤液稀释到1L后溶液的物质的量浓度为多少?分析 发生反应:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,根据方程式计算需要氯酸钾的质量、生成KCl的物质的量,再根据c=$\frac{n}{V}$计算溶液中KCl的物质的量浓度.
解答 解:设需要氯酸钾的质量为m,生成KCl的物质的量为n,则:
2 KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2 KCl+3 O2↑
2×122.5g 2mol 3×22.4L
m n 3.36L
所以m=$\frac{2×122.5g×3.36L}{3×22.4L}$=12.25g
n=$\frac{2mol×3.36L}{3×22.4L}$=0.1mol
故所得溶液中KCl的物质的量=$\frac{0.1mol}{1L}$=0.1mol/L
答:至少需要12.25克氯酸钾,滤液稀释到1L后溶液的物质的量浓度为0.1mol/L.
点评 本题考查化学方程式的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
8.下列实验设计正确的是( )
| A. | SO2中混有CO2,通入饱和NaHSO3溶液,除CO2 | |
| B. | NaCl溶液中混有NaAlO2,通入适量CO2以将Al元素转化为Al(OH)3沉淀,过滤即可 | |
| C. | 欲制备FeCl2固体,可将过量的铁粉在少量氯气中燃烧的方式获得 | |
| D. | 除去SiO2中的Al2O3,加稍过量的稀盐酸,过滤、洗涤、干燥即可 |
9.烧杯中盛放浓度均为0.10mol/L,氯化钠和硝酸铜的混合溶液,现将该溶液以惰性电极电解,当铜离子全部在阴极下转为金属铜时,溶液的pH值为( )
| A. | 7.00 | B. | 1.00 | C. | 0.7 | D. | 1.30 |
6.常温下,实验测得下列四种物质的pH如图所示,下列说法错误的是( )


| A. | 苹果汁的c(H+)=0.3mol•L-1 | B. | 生理盐水是一种中性溶液 | ||
| C. | 石灰水的碱性比肥皂水强 | D. | 石灰水与苹果汁能发生中和反应 |
3.与1L 0.1 mol•L-1 的Na2CO3溶液中含有的钠离子个数相等的是( )
| A. | 6.02×1022个Na+ | B. | 0.1mol NaCl | ||
| C. | 1L 0.1mol•L-1 Na0H溶液 | D. | 28.6g Na2CO3•10H20 |
10.25℃、101kPa下,二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质的物理量正确的是( )
| O2 | Na2CO3 | CO2 | 转移电子数 | |
| A | 1mol | 0.5NA | ||
| B | 0.5mol | 11.2L | ||
| C | 0.25mol | 53g | ||
| D | 8g | NA |
| A. | A | B. | B | C. | C | D. | D |
7.某同学在实验室配制1000mL 0.50mol•L-1 Na2CO3溶液,用此溶液滴定20.00mL盐酸,用甲基橙作指示剂,恰好完全反应时,消耗溶液的体积为18.00mL,则此盐酸的物质的量浓度为( )
| A. | 0.50mol•L-1 | B. | 0.40mol•L-1 | C. | 0.20mol•L-1 | D. | 0.90mol•L-1 |