题目内容
将一定质量的NaHCO3和Na2CO3的固体混合物加热,收集到标准状况下的气体1.12L,然后,向剩下的固体中加入足量的盐酸,又收集到标准状况下的气体5.60L,将反应后的溶液蒸干,所得的白色固体的质量为23.4g,则原固体中NaHCO3的和Na2CO3的质量分别为多少?
考点:钠的重要化合物,化学方程式的有关计算
专题:计算题
分析:加热NaHCO3和Na2CO3的固体混合物发生反应2NaHCO3
Na2CO3+H2O+CO2↑,收集的气体是二氧化碳,n(CO2)=
=0.05mol;
向加热后的固体中加入足量稀盐酸生成二氧化碳,n(CO2)=
=0.25mol,溶液中的溶质为NaCl,将反应后的溶液蒸干,得到的白色固体是NaCl,n(NaCl)=
=0.4mol,
根据C原子、Na原子守恒计算NaHCO3和Na2CO3的物质的量,再根据m=nM计算其质量.
| ||
| 1.12L |
| 22.4L/mol |
向加热后的固体中加入足量稀盐酸生成二氧化碳,n(CO2)=
| 5.6L |
| 22.4L/mol |
| 23.4g |
| 58.5g/mol |
根据C原子、Na原子守恒计算NaHCO3和Na2CO3的物质的量,再根据m=nM计算其质量.
解答:
解:加热NaHCO3和Na2CO3的固体混合物发生反应2NaHCO3
Na2CO3+H2O+CO2↑,收集的气体是二氧化碳,n(CO2)=
=0.05mol;
向加热后的固体中加入足量稀盐酸生成二氧化碳,n(CO2)=
=0.25mol,溶液中的溶质为NaCl,将反应后的溶液蒸干,得到的白色固体是NaCl,n(NaCl)=
=0.4mol,
根据C原子、Na原子守恒得原来混合物中
n(NaHCO3)+n(Na2CO3)=n(CO2)=0.05mol+0.25mol①
n(NaHCO3)+2n(Na2CO3)=n(NaCl)=0.4mol②
由①②得n(NaHCO3)=0.2mol、n(Na2CO3)=0.1mol,
则m(NaHCO3)=0.2mol×84g/mol=16.8g、m(Na2CO3)=106g/mol×0.1mol=10.6g,
答:原固体中NaHCO3的和Na2CO3的质量分别为16.8g、10.6g.
| ||
| 1.12L |
| 22.4L/mol |
向加热后的固体中加入足量稀盐酸生成二氧化碳,n(CO2)=
| 5.6L |
| 22.4L/mol |
| 23.4g |
| 58.5g/mol |
根据C原子、Na原子守恒得原来混合物中
n(NaHCO3)+n(Na2CO3)=n(CO2)=0.05mol+0.25mol①
n(NaHCO3)+2n(Na2CO3)=n(NaCl)=0.4mol②
由①②得n(NaHCO3)=0.2mol、n(Na2CO3)=0.1mol,
则m(NaHCO3)=0.2mol×84g/mol=16.8g、m(Na2CO3)=106g/mol×0.1mol=10.6g,
答:原固体中NaHCO3的和Na2CO3的质量分别为16.8g、10.6g.
点评:本题以钠的重要化合物为载体考查方程式的计算,侧重考查分析、计算能力,利用原子守恒进行计算即可,注意不能根据加热得到的二氧化碳计算碳酸氢钠的质量,碳酸氢钠可能不完全反应,为易错点.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
下列基本反应类型中,一定是氧化还原反应的是( )
| A、复分解反应 | B、置换反应 |
| C、分解反应 | D、化合反应 |
已知NaH和H2O反应生成H2和NaOH,反应中1mol NaH( )
| A、失去1mol电子 |
| B、得到1mol电子 |
| C、失去2mol电子 |
| D、没有电子得失 |
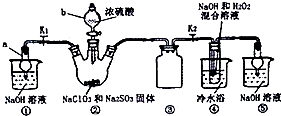 亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.