题目内容
17.能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.回答有关问题:(1)从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量.
(2)已知拆开1molH-H键、1molI-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要放出(填“放出”或“吸收”)5.5kJ的热量.
分析 (1)旧键断裂要吸收能量,新键生成要释放能量;
(2)旧键断裂要吸收能量,新键生成要释放能量,当旧键断裂吸收的能量大于新键生成释放的能量时,反应为吸热反应,反之则为放热反应,据此计算.
解答 解:(1)旧键断裂要吸收能量,新键生成要释放能量,
故答案为:吸收能量;放出能量;
(2)旧键断裂要吸收能量,新键生成要释放能量,当旧键断裂吸收的能量大于新键生成释放的能量时,反应为吸热反应,反之则为放热反应,氢气和碘反应生成2molHI,旧键断裂吸收能量的值为:436kJ+151kJ=587KJ,新键生成释放能量为:299kJ×2=598KJ,旧键断裂吸收的能量小于新键生成释放的能量,反应为放热反应,则由氢气和碘单质反应生成1mol HI需要:$\frac{1}{2}$×(598KJ-587KJ)=5.5KJ,
故答案为:放出;5.5.
点评 本题考查了化学反应中的能量变化及利用键能计算能量的变化,题目难度不大,侧重于基础知识的考查,注意把握由键能计算反应热的方法.

练习册系列答案
相关题目
16.1999年曾报导合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是( )
| A. | N5+共有34个核外电子 | |
| B. | N5+中氮氮原子间以共用电子对结合 | |
| C. | 化合物N5AsF6中As化合价为+1 | |
| D. | 化合物N5AsF6属于离子晶体 |
5.下列反应是吸热反应的是( )
| A. | HCl+NaOH=NaCl+H2O | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | CaO+H2O=Ca(OH)2 |
12.下列物质中含有非极性共价键的离子化合物是( )
| A. | Cl2 | B. | Na2O2 | C. | H2O2 | D. | MgCl2 |
9.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
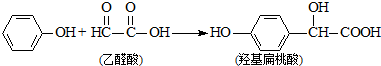
下列有关说法正确的是( )
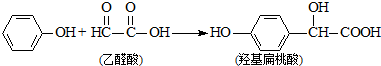
下列有关说法正确的是( )
| A. | 该反应是加成反应 | B. | 苯酚和羟基扁桃酸是同系物 | ||
| C. | 该反应是取代反应 | D. | 乙醛酸不能与 NaOH溶液反应 |
7.有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )
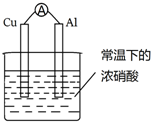

| A. | Cu是原电池的负极 | |
| B. | 电流由Cu电极流出 | |
| C. | 电子由Al沿导线流向Cu | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |